
下列有关电解质溶液的叙述正确的是
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO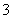 )
)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
下列有关实验的说法不正确的是( )
A、在蒸馏试验中,温度计的水银球位于蒸馏烧瓶支管口处是为了测出馏分的沸点。
B、在重结晶苯甲酸的试验中,步骤是:加热溶解,趁热过滤,冷却结晶。
C、可以用乙醇作萃取剂,提取溴水中的溴单质。
D、冷凝管进水口在下,出水口在上。
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列物质中,受热能放出某气体A,并将所得残渣与盐酸反应又能生成气体A的化合物是( )
A.NH4HCO3 B.K2CO3
C.NaHCO3 D.KClO3
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与生活、社会密切相关。下列说法不正确的是
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.提倡人们购物时不用塑料袋,是为了节约资源,为了防止白色污染
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是
A.已知C(石墨, s)=C(金刚石, s) ΔH>0,则金刚石比石墨稳定
B.已知C(s)+O2(g)=CO2(g) ΔH1 ;C(s)+1/2O2(g)=CO(g) ΔH2,则ΔH2>ΔH1
C.已知2H2(g)+O2(g)=2H2O(g) ΔH= -483.6 kJ/mol,则氢气的燃烧热为241.8kJ/mol
D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在1L密闭容器中,把l mol A和1 mol B混合发生如下反应:3A(g) + B(g)  XC(g) + 2D(g)。当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,则下列叙述不正确的是
XC(g) + 2D(g)。当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,则下列叙述不正确的是
A.x的值为2 B.A的转化率为40%
C.B的平衡浓度为0.8 mol/L D.达到平衡时D的体积分数为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:
CaA(s) Ca2+(aq)+A2-(aq) ΔH > 0。
Ca2+(aq)+A2-(aq) ΔH > 0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c (Ca2+)________,原因是____ ______________(用文字和离子方程式说明)。
(2)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______________________。若某CuSO4溶液中c (Cu2+)=0.02 mol/L,如果要生成Cu(OH)2沉淀,应调整溶液pH,使之大于________(已知Ksp[Cu(OH)2]=2.0×10-20)。
(3)常温下,向某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈________性。在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液时所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中电离出的CO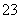 水解所致,请你设计一个简单的实验方案给甲和乙两位同学的说法进行评判(包括简要操作、现象和结论)_________________ ___________。
水解所致,请你设计一个简单的实验方案给甲和乙两位同学的说法进行评判(包括简要操作、现象和结论)_________________ ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知离子方程式:As2S3+H2O+NO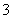 —→AsO
—→AsO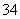 +SO
+SO +NO↑+________
+NO↑+________  (未配平),(已知:As2S3 中As的化合价为+3)则下列说法错误的是( )
(未配平),(已知:As2S3 中As的化合价为+3)则下列说法错误的是( )
A.配平后水的化学计量数为4 B.反应后溶液呈酸性
C.配平后氧化剂与还原剂的物质的量之比为3∶28 D.氧化产物为AsO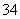 和SO
和SO
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种元素原子的核电荷数依次增大(均小于20),其单质及相应的化合物能发生如下反应关系:

(1)写出F的电子式 。
(2)气体H有毒,可用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________。
(3)加热E的水溶液后并灼烧,最终得到的固体为 , 原因为
, 。(用化学反应方程式来表示)
(4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的PH>7,则此溶液中离子浓度由小到大的顺序为: 。
(5)将气体H放在空气中充分燃烧可得到气体氧化物BO2,BO2可与氧气继续反应:2BO2+O2  2BO3,在一个固定容积为2L的密闭容器中充入0.20 mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则
2BO3,在一个固定容积为2L的密闭容器中充入0.20 mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则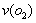 = mol–L-1
= mol–L-1 –min-1。若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于 之间。
–min-1。若继续通入0.20mol BO2和0.10mol O2,再次达到新平衡后,BO3的物质的量介于 之间。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com