
22、写出下列物质反应的离子方程式为
(1)HCl与Na2CO3:____________ ____________;
(2)HCl与AgNO3:____________ ______________。
 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源:2014-2015学年北京市西城区高三上学期期末考试化学试卷(解析版) 题型:选择题
19.(10分)自然界中氮元素有多种存在形式。
(1)合成氨反应的化学方程式是 。
(2)NH3在一定条件下可被氧化。
已知:ⅰ.4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH=﹣1269 kJ/mol
ⅱ.
① 断开1 mol H-O 键与断开 1 mol H-N 键所需能量相差约______kJ;
② H-O 键比H-N键(填“强”或“弱”)______。
(3)下图是某压强下, N2与H2按体积比1: 3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。

① 图中b点,U(正)______ U(逆)。(填“>”、“=”或“<”)
② 图中a点,容器内气体n(N2):n(NH3)= 。
(4)水中的氨在微生物作用下可被氧化为亚硝酸,其化学方程式是 。
(5)电解法能将碱性溶液中的NO2转化为N2而除去,其电极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第二次统练化学试卷(解析版) 题型:填空题
26.(10分)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有 。
(2)硫酸铜溶液可以加快氢气生成速率的原因是 。
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
混合液 | A | B | C | D | E | F |
4mol·L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1= ,V6= ,V9= 。
②反应一段时间后,实验E中的金属呈 色。
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因 。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第二次统练化学试卷(解析版) 题型:选择题
9.下列事实不能用勒夏特列原理解释的是
A.热的纯碱去污效果更好
B.在H2、I2和HI组成的平衡体系加压后,混合气体颜色变深
C.实验室可用排饱和食盐水的方法收集氯气
D.高压下有利于提高合成氨的产率
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省景洪市高一上学期期中化学试卷(解析版) 题型:选择题
17.下列说法错误的是
A.置换反应一定是氧化还原反应
B.化合反应一定是氧化还原反应
C.分解反应可能是氧化还原反应
D.凡是氧化还原反应,都不可能是复分解反应
查看答案和解析>>
科目:高中化学 来源:2014-2015云南省景洪市高一上学期期中化学试卷(解析版) 题型:选择题
10、下列数量的各物质所含原子数按由大到小顺序排列的是
①0.5molNH3 ②标况下22.4LHe ③18g水 ④0.8molNa3PO4
A、①④③② B、④③②① C、②③④① D、④③①②
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省文登市高一上学期期末考试化学试卷(解析版) 题型:选择题
相同条件下Al3+比Mg2+更易与OH-反应生成沉淀。现向浓度均为0.1 mol/L的MgCl2和AlCl3混合溶液中,逐滴加入NaOH溶液,下列示意图表示生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系,合理的是

查看答案和解析>>
科目:高中化学 来源:2014-2015山东省临沂市高一上学期期期末统考化学试卷(解析版) 题型:实验题
(14分)实验室可用如下装置(略去部分夹持仪器)制取SO2并验证其性质。
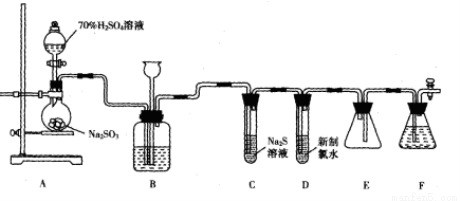
(1)盛装70%H2SO4溶液的仪器名称为_______。仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若_______,则整个装置气密性良好。
(2)装置B的作用之一是通过观察产生气泡的多少判断SO2生成的快慢,其中的液体最好选择_______(填代号)。
a.蒸馏水 b.饱和Na2CO3溶液
c.饱和NaHSO3 溶液 d.饱和NaOH溶液
(3)C试管中的试剂可以验证二氧化硫的氧化性,现象为_______。
(4)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加人品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀。
上述方案合理的是方案_______(填“I”、“Ⅱ”或“Ⅲ”);试管D中发生反应的离子方程式为__________________________________________.
(5)装置E的作用是_______。装置F中为_______溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com