
����pH��2�Ĵ����pH��2�������ң�
��1��ȡ10 mL�ļ���Һ������������ˮ������ĵ���ƽ��___________������������ҡ��������ƶ��������������ı����ᣬ����ĵ���ƽ��___________������������ҡ��������ƶ���������������ˮ�����ƹ��壬�������ܽ����Һ��c��H����/c��CH3COOH����ֵ��___________�����������С������ȷ��������
��2����ͬ�����£�ȡ������ļס�������Һ����ϡ��100����ϡ�ͺ����Һ����pH��С��ϵΪpH���ף�_________pH���ң�������ڡ�����С�ڡ����ڡ�����ͬ���������ס�������Һ�������ϣ���Һ��pH��___________��
��3����ȡ25 mL�ļס�������Һ���ֱ��õ�Ũ�ȵ�NaOHϡ��Һ�к���pH��7�������ĵ�NaOH��Һ�������С��ϵΪV���ף�___________V���ң���
��4��ȡ25 mL����Һ����������pH��12��NaOH��Һ����Ӧ����Һ��c��Na������c��CH3COO�����Ĵ�С��ϵΪc��Na����_________c��CH3COO������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��㶫����ִ����ѧ�߶��������Ļ�ѧ�Ծ��������棩 ���ͣ�?????
��Ԫ����ָÿ�������������ص����֮һ�������ܺͲ�������������ǧ��֮һ�Ľ���ʮ��Ԫ��,��ЩԪ�ض�����������л�ͽ���������Ҫ���á�����Ԫ�ز�����Ԫ�ص���( )
A��I B��H C��Zn D��Fe
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶�12���¿���ѧ���������棩 ���ͣ������
��ѧ������Ԫ�ص��ʼ��仯���ﷴӦ��Ӧ�ù㷺��
��1����һ�������£����淴ӦmA nB+pC��H���ﵽƽ��״̬��
nB+pC��H���ﵽƽ��״̬��
����A��B��C�������壬����ѹǿ��ƽ��������Ӧ�����ƶ����� m n+p������ڡ�����С�ڡ����ڡ�����
m n+p������ڡ�����С�ڡ����ڡ�����
�������������䣬���Ⱥ�A��������С����Ӧ��H 0������ڡ�����С�ڡ����ڡ�����
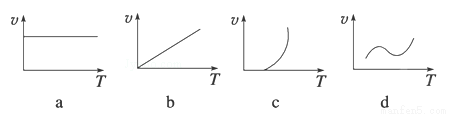
��2��ijЩ�����������FeXOY����ĩ��Al����þ������ȼ�¿��Է������ȷ�Ӧ�����з�Ӧ���ʣ�v�����¶ȣ�T���Ĺ�ϵʾ��ͼ�������ȷ�Ӧ��ӽ����� ������ţ���
��3��һ���¶��£�������Ӧ��FeO�� s��+CO��g��
s��+CO��g�� Fe��s��+CO2��g�� ��H����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����±���
Fe��s��+CO2��g�� ��H����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����±���
�¶�/�� | 1000 | 1100 |
ƽ�ⳣ�� | 0.68 | 0.50 |
��ش��������⣺
�ٸ÷�Ӧ�ġ�H 0�����������������=������
��T��ʱ����FeO��s����CO��g����3.0mol����10L���ܱ������У���Ӧ�ﵽƽ����COת����ΪW1��c��CO2��=0.15mol•L��1�����¶�T ������ڡ��������ڡ��������ڡ���1000������ʱ�����������������ٳ���2.0mol CO��g�����ٴ�ƽ��ʱ���COת����ΪW2����W1 W2�����������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016������ѧ������������Ÿ�һ12�»�ѧ���������棩 ���ͣ�ѡ����
�ö��Ե缫���CuCl2��Һʱ�������������6.4gͭ�������������ϲ���������������״����ԼΪ�� ��
A. 2.24L B. 0.56L C. 0.14L D. 1.12L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶������в��Ի�ѧ�Ծ��������棩 ���ͣ������
��Ҫ����գ�
��1��д����ȡ�������������ˮ�ⷽ��ʽ��
��2����4�л����Һ���ֱ��ɵ����0.1mol/L��2����Һ��϶��ɣ���CH3COONa��HCl��CH3COONa��NaOH��CH3COONa��NaCl��CH3COONa��NaHCO3����c(CH3COO��)�Ӵ�С�Ĺ�ϵΪ ��������ţ���
��3��25��ʱ����֪0.1mol��L��1 CH3COONa��Һ��PH=8����ȷ����������ʽ����ѧ�����
��c(Na+)��c(CH3COO��)�� ����c(OH��)��c(CH3COOH)��
��4������Mg(OH)2������Һ����ε���NH4Cl��Һ�����壬�ù����г����ܽ�����ӷ�Ӧ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶��϶����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪3.6 g̼�� 6.4 g������ȼ�գ�����Ӧ��ľ������ų�X kJ��������֪����̼��ȼ����ΪY kJ/mol����1 mol C��O2��Ӧ����CO�ķ�Ӧ�Ȧ�HΪ
A����Y kJ/mol B������5X��0.5Y�� kJ/mol
C������10X��Y�� kJ/mol D������10X��Y��kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���㽭ʡ��һ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
��ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã��гּ������������ԣ���
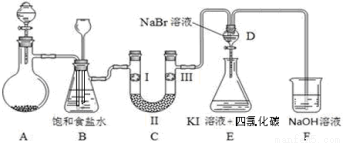
��1���Ʊ�����ѡ�õ�ҩƷΪ�������̺�Ũ���ᣬ����صĻ�ѧ��Ӧ����ʽΪ�� ��
��2��װ��B�б���ʳ��ˮ�������� ��
��3��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C�Т����η��� ��
a | b | c | d | |
�� | �������ɫ���� | �������ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
�� | ��ʯ�� | ��ˮCaCl2 | Ũ���� | ��ˮCaCl2 |
�� | ʪ�����ɫ���� | ʪ�����ɫ���� | �������ɫ���� | �������ɫ���� |
��4�����װ��D��E��Ŀ���DZȽ��ȡ��塢�ⵥ�ʵ�������ǿ��������D�л���ͨ��һ��������ʱ�����Կ�����ɫ��Һ��Ϊ ɫ����Dװ���л�������D��������Һ����װ��E�У����۲쵽�������� �������濼�ǣ���ͬѧ�����ʵ�鷽�����в��㣬��˵�����в����ԭ���� ��
��5��װ��F��������NaOH��Һ����ʣ�����������д����Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ӱ�ʡ�߶������в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ıࣩ�����йػ�ѧ��Ӧ�������仯��������ȷ����
A��������������Ӧ����������ԭ��Ӧ���������ȷ�Ӧ
B����ѧ��Ӧ�е������仯ֻ����Ϊ��������ʽ
C��CaO��H2O��Ca��OH��2��Ӧ�����У��ɼ��������յ�����С���¼��γ��ͷŵ�����
D�����������ͬʱ�����ȷ�Ӧ������һ���������ȷ�Ӧ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���㽭ʡ�߶������в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��2A(g����B(g�� 3C(g����4D(g����Ӧ�У���ʾ�÷�Ӧ����������
3C(g����4D(g����Ӧ�У���ʾ�÷�Ӧ����������
A����(A���� 0.5 mol �� L-1����-1
B����(B���� 0.3 mol �� L-1����-1
C����(C���� 0.8 mol ��L-1����-1
D����(D���� 1 mol �� L-1����-1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com