
 离子交换膜是一类具有离子交换功能的高分子材料,在生产和研究中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示:
离子交换膜是一类具有离子交换功能的高分子材料,在生产和研究中有广泛应用.一容器被离子交换膜分成左右两部分,如图所示:

科目:高中化学 来源: 题型:
| A、分液、蒸馏、萃取 |
| B、萃取、蒸馏、分液 |
| C、蒸馏、萃取、分液 |
| D、分液、萃取、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
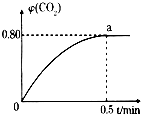 运用化学反应原理研究碳的化合物具有重要意义.
运用化学反应原理研究碳的化合物具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 有X、Y、Z三种元素,原子序数依次增大,它们的原子序数之和为43.其中,Y原子的最外层电子数是次外层电子数的三倍.X、Y元素的单质都是构成空气的主要成分.
有X、Y、Z三种元素,原子序数依次增大,它们的原子序数之和为43.其中,Y原子的最外层电子数是次外层电子数的三倍.X、Y元素的单质都是构成空气的主要成分.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一些有机溶剂(如乙醚、乙醇、苯、丙酮等)极易被引燃,使用时必须远离明火和热源用毕立即塞紧瓶塞 |
| B、在两支试管中分别加1mL无水乙醇和1.5g苯酚固体,再加等量的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
| C、减压过滤洗涤沉淀时,应先关闭水龙头,在布氏漏斗上加上洗涤剂,然后开大水龙头,使洗涤剂快速通过沉淀物 |
| D、酚醛树脂制备实验完毕后应及时清洗试管,如果不易洗涤,可以加入少量盐酸,浸泡几分钟,然后清洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com