

分析 在实验中利用CaSO4、NH3、CO2制备(NH4)2SO4,由于碱性条件下有利于二氧化碳的吸收,将二氧化碳转化为碳酸根离子,进而得到CaCO3沉淀,故CaSO4溶液先通入足量的氨气,使溶液成碱性,再通适量的二氧化碳,经过过滤分离得到CaCO3与滤液,再煅烧CaCO3生成生石灰与二氧化碳,滤液中含有硫酸铵,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸铵晶体.
(1)操作I是过滤,操作Ⅱ从溶液中获得晶体;
(2)CaSO4、NH3、CO2反应生成CaCO3、(NH4)2SO4;
(3)由上述分析,可知X为氨气、Y为二氧化碳;
(4)反应得到16.3l g固体为BaSO4,根据硫酸根守恒计算n[(NH4)2SO4],再根据m=nM计算m[、(NH4)2SO4],进而计算所制得硫酸铵的纯度;
向溶液中滴加过量的氯化钡溶液,目的是使硫酸根离子完全沉淀,静置后向上层清液再滴加氯化钡溶液,根据是否有沉淀生成,可以检验氯化钡是否已过量;
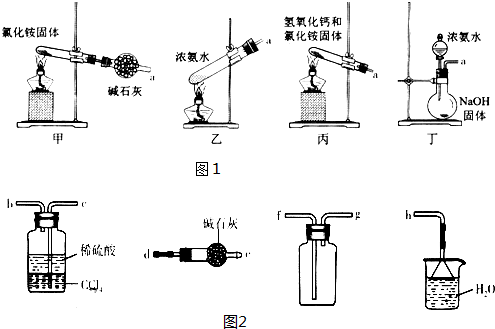
(5)甲中直接加热NH4Cl生成 NH3和HCl,在试管口附近又生成了NH4Cl;乙中加热浓氨水促进NH3的挥发,可制取NH3;丙中加热氢氧化钙和氯化铵固体,发生复分解反应生成NH3;丁中浓氨水滴加到NaOH固体中,可挥发出NH3;
因为收集干燥的NH3,用碱石灰干燥NH3,用向下排空气法收集NH3,通入稀硫酸,制取硫酸铵,后面连接h,进行尾气处理;把NH3直接通入稀硫酸中会发生倒吸,而NH3难溶于CCl4,所以CCl4的作用是防倒吸.
解答 解:在实验中利用CaSO4、NH3、CO2制备(NH4)2SO4,由于碱性条件下有利于二氧化碳的吸收,将二氧化碳转化为碳酸根离子,进而得到CaCO3沉淀,故CaSO4溶液先通入足量的氨气,使溶液成碱性,再通适量的二氧化碳,经过过滤分离得到CaCO3与滤液,再煅烧CaCO3生成生石灰与二氧化碳,滤液中含有硫酸铵,经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸铵晶体.
(1)操作I是过滤,用到的玻璃仪器有烧杯、漏斗、玻璃棒,操作Ⅱ从溶液中获得硫酸铵晶体,硫酸铵的溶解度随温度的降低而减小,所以蒸发浓缩后进行冷却结晶,
故答案为:漏斗、玻璃棒;冷却结晶;
(2)CaSO4、NH3、CO2反应生成CaCO3、(NH4)2SO4,反应方程式为:CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4,
故答案为:CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4;
(3)由上述分析,可知X为氨气、Y为二氧化碳,故答案为:NH3;CO2;
(4)向溶液中滴加过量的氯化钡溶液,目的是使硫酸根离子完全沉淀,静置后向上层清液再滴加氯化钡溶液,若没有沉淀生成,说明氯化钡溶液过量,反之,氯化钡溶液不足,
反应得到16.3l g固体为BaSO4,根据硫酸根守恒:n[(NH4)2SO4]=n(BaSO4)=$\frac{16.31g}{233g/mol}$=0.07mol,则m((NH4)2SO4)=0.07mol×132g/mol=9.24g,硫酸铵的纯度=$\frac{9.24g}{10.0g}$×100%=92.4%;
故答案为:静置后向上层清液再滴加氯化钡溶液,若没有沉淀生成,说明氯化钡溶液过量,反之,氯化钡溶液不足;92.4%;
(5)甲.直接加热NH4Cl生成 NH3和HCl,在试管口附近NH3和HCl反应又生成了NH4Cl,所以不能用来制取NH3,故甲错误;
乙.氨水中存在平衡关系:NH3+H2O═NH3•H2O═NH4++OH-,加热浓氨水,氨气溶解度降低,从溶液中逸出,平衡向逆反应方向移动,可制取NH3,故乙正确;
丙.加热氢氧化钙和氯化铵固体,发生复分解反应生成NH3,可用于制取NH3,故丙正确;
丁.CaO与H2O反应生成Ca(OH)2,放出大量热,促进NH3•H2O的分解及NH3的挥发逸出,又由于Ca(OH)2是强碱,也促进NH3•H2O的分解及NH3的挥发逸出,能用于制取NH3,故丁正确;
因为要收集干燥的NH3,用碱石灰干燥NH3,所以a后接d、e,用向下排空气法收集NH3,后面连接g、f,通入稀硫酸,制取硫酸铵,后面连接c、b,最后连接h,进行尾气处理;
把NH3直接通入稀硫酸中会发生倒吸,而NH3难溶于CCl4,所以CCl4的作用是防倒吸,
故答案为:乙丙丁;d、e、g、f、c、b、h;防倒吸.
点评 本题考查化学工艺流程、实验方案设计、物质分离提纯、化学计算、氨气制备等,是对基础知识的综合运用,较好的考查学生分析解决问题的能力,难度中等.


科目:高中化学 来源: 题型:解答题
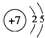 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液:NH4+、Al3+、NO3-、CO32- | |
| B. | 0.1 mol•L-1NaHCO3溶液:Na+、Ba2+、NO3-、OH- | |
| C. | 滴加KSCN溶液显红色的溶液:NH4+、K+、Cl-、NO3- | |
| D. | 由水电离出的c(H+)=10-12mol•L-1的溶液:Na+、K+、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
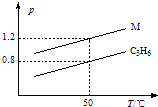 图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )
图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )| A. | SO2 | B. | CO2 | C. | C3H8 | D. | CO和N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数相等、电子数和原子数不相等:① | |
| B. | 质子数和电子数相等、原子数不相等:② | |
| C. | 电子数相等、质子数和原子数不相等:③ | |
| D. | 原子数和电子数相等、质子数不相等:④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3分子的结构式: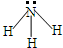 | |
| B. | NH4Cl的电子式: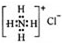 | |
| C. | 原子核内有10个中子的氧原子:818O | |
| D. | Cl-离子的结构示意图: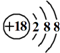 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A的量,B的转化率提高 | |
| B. | 压强增大平衡不移动,v(正)、v(逆)均不变 | |
| C. | 增大B的浓度,v(正)>v(逆) | |
| D. | 升高温度,平衡向逆反应方向移动,v(正)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com