
| A. | 若a≤b,则混合溶液的pH大于7 | |
| B. | 若a=2b,溶液呈酸性,则[CH3COO-]>[Na+]>[CH3COOH]>[H+]>[OH-] | |
| C. | 混合溶液中[Na+]+[H+]=[OH-]+[CH3COO-]一定成立 | |
| D. | 混合溶液中[CH3COO-]+[CH3COOH]=a mol/L 一定成立 |
分析 A.a=b时,醋酸与NaOH恰好反应生成醋酸钠,溶液显碱性,a<b时,NaOH过量;
B.若a=2b,醋酸过量,溶液中溶质为等浓度的醋酸与醋酸钠,溶液显酸性;
C.根据溶液中的电荷守恒分析;
D.溶液的体积不知道,无法计算浓度.
解答 解:A.a mol CH3COOH和b mol NaOH的两溶液混合,a=b时,醋酸与NaOH恰好反应生成醋酸钠,溶液显碱性,a<b时,NaOH过量,溶液显碱性,所以若a≤b,则混合溶液的pH大于7,故A正确;
B.若a=2b,醋酸过量,溶液中溶质为等浓度的醋酸与醋酸钠,溶液显酸性,醋酸的电离程度大于醋酸钠的水解程度,则[CH3COO-]>[Na+]>[CH3COOH]>[H+]>[OH-],故B正确;
C.a mol CH3COOH和b mol NaOH的两溶液混合,溶液中存在Na+、CH3COO-、H+、OH-,溶液中的电荷守恒为[Na+]+[H+]=[OH-]+[CH3COO-],故C正确;
D.CH3COOH的物质的量为amol,但是溶液的体积不知道,无法计算醋酸的浓度,故D错误.
故选D.
点评 本题考查了弱电解质的电离平衡、盐类的水解、溶液中离子浓度大小的比较,题目难度中等,难点是离子浓度大小的比较,可根据物料守恒、电荷守恒进行分析判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
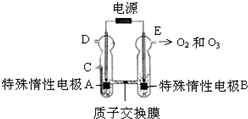 臭氧是一种强氧化剂,常用于消毒、灭菌等.
臭氧是一种强氧化剂,常用于消毒、灭菌等.pH t/min T/℃ | 3,.0 | 4,.0 | 5,.0 | 6,.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢有三种同素异形体,分别是氕、氘、氚 | |
| B. | 氢有三种同位素,它们的相对原子质量分别是1、2、3 | |
| C. | 氢元素可形成三种互为通分异构体的物质:H2、D2、T2 | |
| D. | 氢元素的三种同位素原子可用一个原子结构示意图表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
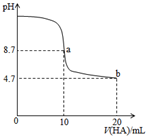 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | b点所示溶液中c(A-)>c(HA) | |
| D. | 滴定过程中不可能出现c(Na+)>c(OH-)>c(A-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
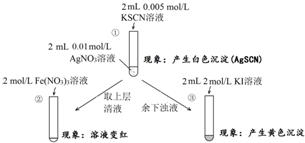
| A. | ①浊液中存在平衡:AgSCN(s)?Ag+(aq)+SCN-(aq) | |
| B. | ②中颜色变化说明上层清液中含有SCN- | |
| C. | ③中颜色变化说明有AgI生成 | |
| D. | 该实验可以证明AgI比AgSCN更难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
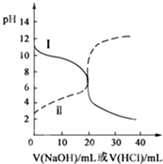 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A. | 曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| B. | 曲线Ⅰ:滴加溶液到20 mL时:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| C. | 曲线Ⅱ:滴加溶液在10 mL~20 mL之间时:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
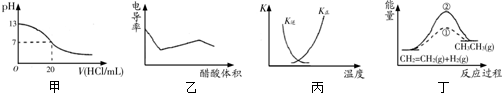
| A. | 甲表示25℃时用0.1 mol/L的盐酸滴定20 mL 0.1 mol/L KOH溶液,溶液的pH随加入盐酸体积的变化 | |
| B. | 乙表示醋酸溶液滴定NaOH和氨水混合溶液的电导率曲线 | |
| C. | 丙中曲线表示反应N2(g)+3H2(g)?2NH3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| D. | 丁中①、②曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
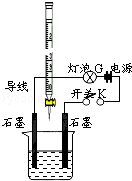 有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.
有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.常温下,水的离子积Kw=1×10-14.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com