
| A. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA | |
| B. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| C. | 4℃时,18g 2H216O中含有共用电子对数为2NA | |
| D. | 常温下,4gCH4含有NA 个C-H共价键 |
分析 A、合成氨的反应为可逆反应;
B、标况下四氯化碳为液态;
C、18g 2H216O的物质的量为0.9mol,然后根据 2H216O中含2对共用电子对来分析;
D、求出甲烷的物质的量,然后根据甲烷中含4条C-H键来分析.
解答 解:A、合成氨的反应为可逆反应,不能进行彻底,故转移的电子数小于0.6NA个,故A错误;
B、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、18g 2H216O的物质的量为0.9mol,而 2H216O中含2对共用电子对,故0.9mol中含1.8NA对共用电子对,故C错误;
D、4g甲烷的物质的量为0.25mol,而甲烷中含4条C-H键,故0.25mol甲烷中含NA条C-H键,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | Be(OH)2是两性氢氧化物 | |||||
| B. | 硫粉不溶于水,易溶于CS2中 | |||||
| C. | O3与SO2的结构不相似 | |||||
| D. | 由图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数
|
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤ | C. | ①②⑤ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
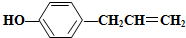 ,下列叙述不正确的是( )
,下列叙述不正确的是( )| A. | 1 mol胡椒粉最多可与4 mol氢气发生反应 | |
| B. | 1 mol胡椒粉最多可与3 mol溴水发生反应 | |
| C. | 胡椒粉可与氯化铁溶液反应,使溶液呈紫色 | |
| D. | 胡椒粉与NaHCO3溶液反应产生CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
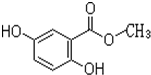 .
.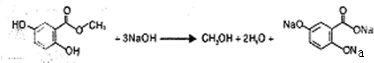 .
.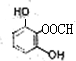 、
、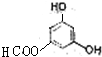 .
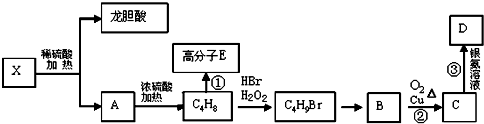
.
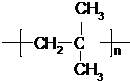 .
.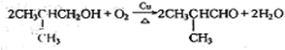 .
.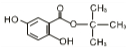 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期X、Y、Z元素的最高价含氧酸的酸性:HXO4>H2YO4>H3ZO4,则气态氢化物还原性HX<H2Y<ZH3 | |
| B. | 元素R的含氧酸的化学式是H2RO3,则其气态氢化物的化学式就是RH4 | |
| C. | 金属与非金属元素分界线附近的元素是过渡元素 | |
| D. | 物质的量相同的Na+、O2-、NH3三种微粒,一定含有相同的质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加适量NaOH溶液并煮沸片刻 | |
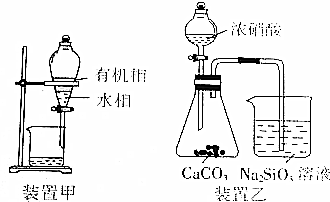
| B. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| C. | 用装置乙进行实验,证明酸性:硝酸>碳酸>硅酸 | |
| D. | 探讨改变浓度研究反应“2Fe3++2I-?2Fe2++I2”中Fe3+和Fe2+的相互转化:向3mL 0.05mol•L-1Fe2(SO4)3溶液中加入3 mL 0.01mol•L-1 KI溶液,将所得黄色溶液等分成三份,第一份加入数滴0.01 mol•L-1AgNO3溶液,第二份加入1mL0.01mol•L-1FeSO4溶液,第三份加1mL水,观察并比较实验现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com