
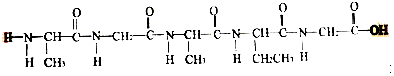 是一种由三种α-氨基酸分子脱水缩合生成的五肽的结构简式,这种五肽彻底水解时,不可能产生的氨基酸是( )
是一种由三种α-氨基酸分子脱水缩合生成的五肽的结构简式,这种五肽彻底水解时,不可能产生的氨基酸是( )| A. | 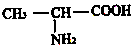 | B. | 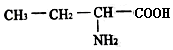 | ||
| C. | 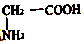 | D. | 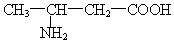 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 称取2.0g NaOH固体 | 先在左、右两托盘上各放一张滤纸,然后在有盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 检验试液巾是否含有NH4+ | 取少量试液于试管巾,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
| C | 除去CO2中混有的杂质SO2 | 将混合气体通入盛有澄清石灰水的洗气瓶中 |
| D | 验证金属钠比铜活泼 | 将钠加入1.0mol•L-1的CuSO4溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4C1固体和Ba(OH)2晶体在常温下混合即可反应,是因为该反应是放热反应 | |
| B. | CO(g)的燃烧热是-283.0 KJ/mol,则 2CO2(g)═2CO(g)+O2(g)的反应热 为△H=+566.0 KJ/mol | |
| C. | 含1 mol Ba(OH)2的溶液和含1 mol H2SO4的溶液反应放出的热量是中和热 | |
| D. | 1 mol CH4燃烧生成水蒸气和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 30 | 150 | 250 | 350 | 450 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com