
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.一氧化氮是一种红棕色的气体 |
| B.一氧化氮的摩尔质量为30 |
| C.常温常压下,一氧化氮能与空气中的氧气直接化合 |
| D.一氧化氮易溶于水,不能用排水法收集 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
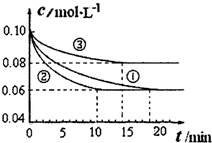
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨气通人酚酞试液,溶液变红色 |
| B.品红溶液中通入SO2,溶液褪色,加热后红色复原 |
| C.向淀粉KI溶液中滴人几滴氯水,溶液变蓝 |
| D.向紫色石蕊试液中通Cl2,溶液先变红后褪色,加热后紫色复原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫酸和硝酸是重要的工业原料,工业上可用于制化肥、农药、和炸药 |
| B.石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料 |
| C.因为氨易液化,在汽化时会吸收大量的热量,所以可作制冷剂 |
| D.测NaOH熔点时可以将NaOH放入石英坩埚中高温加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.除④⑦外 | B.除①③外 | C.除③④外 | D.除①④外 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.92gNO2和N204混合气体中含有的原子数为3NA |
| B.标准状况下,11.2LH2O中含有的电子数为20NA |
| C.0.5mol?L“的Ba(0H)2溶液中0H一的数目为NA |
| D.1molMg与足量的02或N2反应生成MgO或Mg3N2时,失去的电子数均为2N |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.可用浓硝酸和铁反应制取氢气 |
| B.浓硝酸是强酸,稀硝酸是弱酸 |
| C.常温下,铜和浓硝酸反应,与稀硝酸不反应 |
| D.常温下可以用,铝槽车装运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

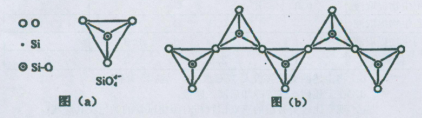
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com