
【题目】10℃时加热![]() 饱和溶液,测得该溶液的pH发生如下变化:
饱和溶液,测得该溶液的pH发生如下变化:

(1)![]() 饱和溶液中存在三个平衡关系,写出三个平衡表达式 :________;_______;______。
饱和溶液中存在三个平衡关系,写出三个平衡表达式 :________;_______;______。
(2)甲同学认为,该溶液的pH升高的原因是![]() 的水解程度增大,故碱性增强。乙同学认为,溶液的pH升高的原因是
的水解程度增大,故碱性增强。乙同学认为,溶液的pH升高的原因是![]() 受热分解,生成了
受热分解,生成了![]() ,并推断
,并推断![]() 的水解程度________(填“大于”或“小于”)
的水解程度________(填“大于”或“小于”)![]() 。丙同学认为将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 ____________(填“甲”或“乙”)判断正确。
。丙同学认为将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 ____________(填“甲”或“乙”)判断正确。
(3)丁同学向饱和![]() 溶液中加入饱和
溶液中加入饱和![]() 溶液,观察到有白色沉淀和无色气体,经检验该白色沉淀为碳酸钙沉淀,试利用沉淀溶解平衡表达式和K、Q关系分析产生该沉淀的原因 ____________。
溶液,观察到有白色沉淀和无色气体,经检验该白色沉淀为碳酸钙沉淀,试利用沉淀溶解平衡表达式和K、Q关系分析产生该沉淀的原因 ____________。
【答案】![]()
![]()
![]() 大于 甲 加入饱和
大于 甲 加入饱和![]() 溶液后,溶液中钙离子浓度与碳酸根离子浓度的乘积大于
溶液后,溶液中钙离子浓度与碳酸根离子浓度的乘积大于![]() ,使
,使![]() ,向产生沉淀的方向进行
,向产生沉淀的方向进行
【解析】
根据弱根离子的水解规律进行判断。弱酸的酸式酸根既能水解也能电离,溶液的酸碱性由电离和水解的程度进行判断![]() 属于弱酸的酸式盐,
属于弱酸的酸式盐,![]() 既能发生水解又能发生电离,因为
既能发生水解又能发生电离,因为![]() 溶液显碱性,所以电离小于水解。
溶液显碱性,所以电离小于水解。
(1)![]() 属于强碱弱酸的酸式盐,所以溶液中有水的电离,
属于强碱弱酸的酸式盐,所以溶液中有水的电离,![]() -的电离和水解,所以三个平衡关系表达式为:
-的电离和水解,所以三个平衡关系表达式为:![]() ;
;![]() ;
;![]() ;
;
(2)![]() 为强碱弱酸盐,在溶液中发生水解反应:
为强碱弱酸盐,在溶液中发生水解反应:![]() ,水解呈碱性,加热时,
,水解呈碱性,加热时,![]() 可分解生成Na2CO3,Na2CO3的水解程度较大,溶液碱性较强。由已知10℃时
可分解生成Na2CO3,Na2CO3的水解程度较大,溶液碱性较强。由已知10℃时![]() 溶液的pH等于8.3,所以丙同学认为将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则甲判断正确;
溶液的pH等于8.3,所以丙同学认为将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则甲判断正确;
(3)![]() 发生电离
发生电离![]() ,滴加几滴饱和
,滴加几滴饱和![]() 溶液,有白色沉淀生成,说明Ca2+和CO32-的乘积大于
溶液,有白色沉淀生成,说明Ca2+和CO32-的乘积大于![]() 结合生成了CaCO3沉淀,促进了
结合生成了CaCO3沉淀,促进了![]() 的电离。答案:加入饱和
的电离。答案:加入饱和![]() 溶液后,溶液中钙离子浓度与碳酸根离子浓度的乘积大于
溶液后,溶液中钙离子浓度与碳酸根离子浓度的乘积大于![]() ,使
,使![]() ,向产生沉淀的方向进行。
,向产生沉淀的方向进行。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如图,下列叙述不正确的是( )
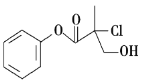
A. 有机物A属于芳香族化合物
B. 有机物A和NaOH的醇溶液共热可发生消去反应
C. 有机物A和浓硫酸混合加热,可以发生消去反应
D. 1molA和足量的NaOH溶液反应,最多可以消耗 3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
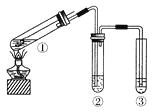
A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下:![]() 。取适量黄色
。取适量黄色![]() 固体配制成100mL溶液,配制过程中溶液的离子浓度与时间的变化关系如图所示。下列说法中正确的是( )
固体配制成100mL溶液,配制过程中溶液的离子浓度与时间的变化关系如图所示。下列说法中正确的是( )
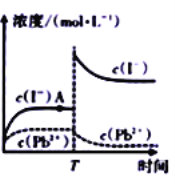
A. A点处可表示![]() 的不饱和溶液
的不饱和溶液
B. T时刻有可能向该![]() 溶液中加人了KI 固体
溶液中加人了KI 固体
C. 常温下![]() 饱和溶液中的
饱和溶液中的![]()
D. 向A点处的![]() 悬浊液中加入
悬浊液中加入![]() 的
的![]() 溶液,平衡后溶液中的c(Pb2+)<4
溶液,平衡后溶液中的c(Pb2+)<4![]() 10-3mol/L
10-3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种金属单质,B溶液能使酚酞试液变红,且焰色反应呈黄色;D、F相遇会产生白烟。A、B、C、D、E、F间有如下变化关系:

(1)写出A、B、C、E的化学式:
A__________,B__________,C__________,E__________。
(2)写出E→F反应的化学方程式_________;写出B→D反应的化学方程式_________。
(3)F在空气中遇水蒸气产生白雾现象,这白雾实际上是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如图所示的装置进行实验,过一段时间后观察,下列现象不可能出现的是( )
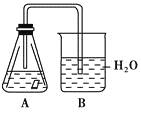
A.B中导气管中产生气泡B.B中导气管里形成一段水柱
C.金属片剪口变红D.锌被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是三种常见的短周期元素,可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物。已知Y的离子和Z的离子具有相同的电子层结构,X离子比Y离子多1个电子层。
(1)X离子的结构示意图为______。
(2)Z2Y对应水化物的碱性比LiOH的_____(填“强”或“弱”),Z2Y对应水化物的电子式为________________
(3)Z2X属于_____(填“共价”或“离子”)化合物,用电子式表示Z2X的形成过程________________
(4)Z2Y2含有_____键和______键,电子式为___________________,Z2Y2溶于水时发生反应的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路由正极流向负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com