
【题目】一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如下图所示,则下列说法中正确的是
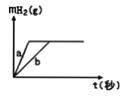
A. 投入的Na、K一定等质量
B. 投入的Na的质量大于K的质量
C. 曲线a为K,b为Na
D. 稀盐酸的量一定是不足量的
科目:高中化学 来源: 题型:
【题目】(10分)铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物。某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验。
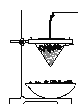
(1)取磁性氧化铁按图装置进行铝热反应,引发铝热反应的实验操作是______________,
现象很壮观,取少许反应生成的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种结果的原因,除了可能混有没反应的磁性氧化铁外,还有一个原因是 。
(2)设计一个简单的实验方案,证明上述所得的“铁块”中含有金属铝。该实验所用试剂是_________,反应的离子方程式为___________________________________________。
(3)请写出此铝热反应的化学方程式: 。
每摩铝参与反应,转移的电子数为 。
(4)生成除磁性氧化铁可做铝热反应实验外,下列哪些试剂也可以________。
A.CuO B.Na2O2 C.MnO2 D.MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用自来水养鱼时,通常先将自来水晒一段时间后再注入鱼缸,目的是 ( )
A.提高水温 B.增加水中氯气的含量
C .除去水中少量的次氯酸 D.用紫外线杀死水中的细菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、A12O3,不考虑其他杂质)制取FeSO4·7H2O,其制备工艺流程如下:
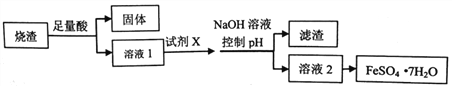
结合所学知识回答:
(1)溶解烧渣选用的酸应为_____(填化学式),选用的试剂X为_____(填试剂名称)。
(2)加入NaOH控制pH的目的是____________。
(3)从溶液2得到FeSO4·7H2O的实验操作主要步骤是________________________。
(4)为了测定获得的绿矾产品的纯度,进行了如下实验操作:
I.称取2.850g绿矾产品,溶解,用250mL容量瓶配制成待测液;
II.量取25.00mL待测溶液置于锥形瓶中;
III.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为 20.00mL。
①判断此滴定实验达到终点的方法是____________。
②该滴定反应的离子方程式为___________________。
③上述样品中FeSO4·7H2O的纯度为____________________。
(5)古代炼丹家以绿矾(FeSO4·7H2O)为原料,放在炼丹炉中锻烧可制得绿矾油。下图是2.780 g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线。将加热产生的所有气体通入足量的BaCl2溶液,得到白色沉淀1.165 g。则t1~t2段发生反应的化学方程式为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用HCl的质量分数为36.5%的浓盐酸(密度为1.20g/cm3) 配置1L 1mol/L的稀盐酸。回答下列有关问题。完成下述操作步骤:
(1)计算:需量取36.5%的浓盐酸的体积为________毫升。
(2)量取:用量筒量取所需浓盐酸并注入到250mL烧杯中;
(3)溶解:___________________________________________________并冷却。
(4)转移(移液):_________________________________________________。
(5)洗涤:__________________________________________________________。
(6)定容:__________________________________________________________。
(7)摇匀:盖好容量瓶塞,反复颠倒、摇匀;
(8)储藏:将配置好的稀盐酸倒入试剂瓶中,并贴好标签。标签上要注明______________。
(9)误差分析:以下操作造成配得的盐酸浓度是“偏高”、“相等”还是“偏低”?
①用量筒量取浓盐酸后,用蒸馏水洗涤筒量后的溶液转入容量瓶中;____________。
②容量瓶中有少量的蒸馏水;__________________。
③没有将洗涤烧杯和玻璃棒的溶液转入容量瓶中;___________。
④定容读数时,府视容量瓶的刻度线;________________。
⑤定容摇匀后发现容量瓶中液面低于刻度线,又加水;________________。
⑥未冷却就转移定容;_____________________。
⑦润洗了容量瓶;_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全世界每年钢铁因锈蚀造成大量的损失。某城市拟用如图方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是( )
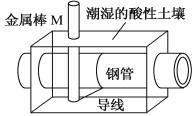
A.土壤中的钢铁易被腐蚀是因为在潮湿的土壤中形成了原电池
B.金属棒M的材料应该是比镁活泼的金属
C.金属棒M上发生反应:M-ne-=Mn+
D.这种方法称为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且![]() 的值与温度高低有关。当n(KOH)=a mol,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=a mol,下列有关说法错误的是( )
A.若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]() =
=![]()
B.参加反应的氯气的物质的量等于![]() a mol
a mol
C.改变温度,反应中转移电子的物质的量ne的范围:![]() a mol≤ne≤
a mol≤ne≤![]() a mol
a mol
D.改变温度,产物中KClO3的最大理论产量为![]() a mol
a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见的某反应化学方程式为X +Y→M+N +H2O(未配平,反应条件已略去),下列叙述错误的是
A. 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B. 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
C. 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3- = Fe3+ +NO↑+2H2O
D. 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com