
分析 (1)反应的化学方程式为:Fe+CuSO4=FeSO4+Cu,先进行过量计算,根据不足量物质计算,据此解答;
(2)根据反应中硫酸根离子的物质的量守恒计算;
(3)根据参加反应的铁的量求反应消耗的硫酸铜的物质的量,再求出剩余的硫酸铜,即可求出铜离子的物质的量和浓度.
解答 解:(1)设10g硫酸铜完全反应需要Fe的质量为m,则:
Fe+CuSO4=FeSO4+Cu
56 160
m 10g
所以m=3.5g>2.8g,故Fe不足,Fe完全反应,
根据Fe元素守恒:m(FeSO4)=$\frac{2.8g×152}{56}$=7.6g;
答:生成FeSO4的质量为7.6g;
(2)反应中硫酸根离子的物质的量不变,则n(SO42-)=n(CuSO4)=$\frac{10g}{160g/mol}$=0.0625mol,
所以c(SO42-)=$\frac{0.0625mol}{0.1L}$=0.625mol/L;
答:反应后的溶液中SO42-的物质的量浓度是0.625mol/L;
(3)Fe完全反应后,生成Cu的物质的量nmol,则:
Fe+CuSO4=FeSO4+Cu
56 1mol
2.8g nmol
解得n=0.05mol,则溶液中剩余的Cu2+的物质的量浓度是$\frac{0.0625mol-0.05mol}{0.1L}$=0.125mol/L;
答:溶液中剩余的Cu2+的物质的量浓度是0.125mol/L.
点评 本题考查根据化学方程式的计算,比较基础,旨在考查学生对基础知识的理解掌握,注意过量计算.


科目:高中化学 来源: 题型:选择题
| A. | 铀(U)的两种核素:${\;}_{92}^{235}$U和${\;}_{92}^{238}$U | |
| B. | CO2的结构式:O=C=O | |
| C. | 乙醇分子的比例模型: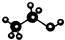 | |
| D. | Cl-结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+,C6H5O-,CH3COO-,MnO4- | B. | 葡萄糖,Cu2+,Na+,OH- | ||
| C. | Fe3+,NO3-,SO42-,H+ | D. | OH-,Al3+,NH4+,AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
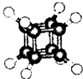
| A. | 它的一氯代物只有一种同分异构体 | |
| B. | 它的二氯代物有三种同分异构体 | |
| C. | 它与苯乙烯(C6H5-CH=CH2)互为同分异构体 | |
| D. | 它是一种不饱和烃,既能发生取代反应,又能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 改变的条件 | 新平衡与原平衡比较 | |
| A | 向容器中充入He气 | X的转化率变大 |
| B | 增大压强 | X的浓度变大 |
| C | 充入一定量Y | Y的转化率增大 |
| D | 使用适当催化剂 | X的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
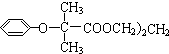
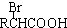 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$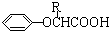
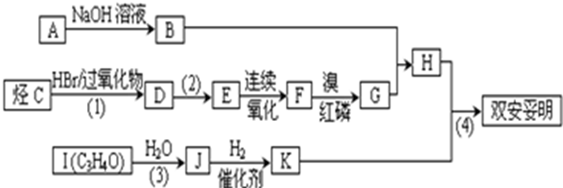

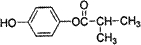 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
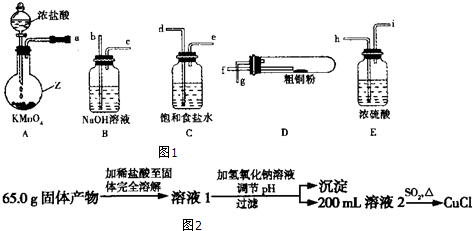
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com