
| 测定时刻/s | t1 | t2 | t3 | t4 |
| C(A)/mol?L-1 | 6 | 3 | 2 | 2 |
| C(B)/mol?L-1 | 5 | 3.5 | 3 | 3 |
| C(C)/mol?L-1 | 1 | 2.5 | 3 | 3 |
| A、在容器中发生的反应为2A(g)+B(g)?2C(g) |
| B、该温度下,此反应的平衡常数为0.25 |
| C、A的转化率比B转化率的低 |
| D、在t3时刻反应已经停止 |
| 3 |
| 3×22 |
| 3 |
| 8 |
| 1.5 |
| 6 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、 将海带灼烧成灰 |
B、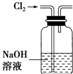 除去Cl2中混有的HCl气体 |
C、 验证NH3易溶于水 |
D、 蒸干NH4Cl饱和溶液制备NH4Cl 晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、G→a→e→b→f→d→c |
| B、G→c→d→b→e→f→a |
| C、G→a→e→f→b→d→c |
| D、G→b→e→f→a→d→c |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol C |
| B、1 mol B和1 mol C |
| C、2 mol A、1 mol B |
| D、3 mol A、0.5 mol B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+ |
| B、浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同 |
| C、向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42- |
| D、常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH溶液与CH3COOH溶液混合至中性后:c(CH3COO-)=c(Na+)=c(H+)=c(OH-) |
| B、pH=3的CH3COOH溶液与pH=11的KOH溶液等体积混合后:c(K+)>c(CH3COO-)>c(OH-)>c(H+) |
| C、pH=2的HNO3溶液与pH=12的NH3?H2O溶液等体积混合后:c(NH4+)>c(H+)>c(OH-)>c(NO3-) |
| D、pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,c(NH4+)大小顺序:①=②>③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com