
| A. | 4种 | B. | 8种 | C. | 11种 | D. | 12种 |
分析 分子式为C8H8O2的含有苯环有机物,不饱和度为$\frac{2×8+2-8}{2}$=5,能与NaHCO3溶液反应生成气体,含有羧基和苯环,可能含有1个侧链,侧链为-CH2COOH,可能含有2个侧链,侧链为-COOH、-CH3,有邻、间、对三种.
解答 解:分子式为C8H8O2的含有苯环有机物,能与NaHCO3溶液反应生成气体,含有羧基和苯环,可能含有1个侧链,侧链为-CH2COOH,可能含有2个侧链,侧链为-COOH、-CH3,有邻、间、对三种,故符合条件的同分异构体有: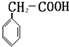 或
或 或
或 或
或 ,共有4种,故选A.
,共有4种,故选A.
点评 本题主要考查了有机物的推断,明确有机物的不饱和度是解本题关键,难度中等.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
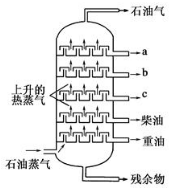
| A. | 在a、b、c三种馏分中,a的熔点最高 | |
| B. | 分馏产品的沸点:a>b>c>柴油>重油 | |
| C. | 在a、b、c三种馏分中,c的平均相对分子质量最大 | |
| D. | a、b、c、柴油、重油都是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| H2(g) | Br2(g) | HBr(g) |
| 436kJ | akJ | 369kJ |
| A. | 200 | B. | 230 | C. | 260 | D. | 404 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
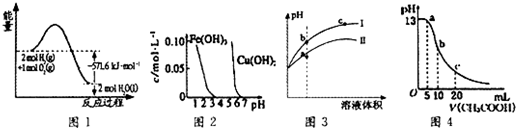
| A. | 图1表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ/mol | |
| B. | 由图2得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 | |
| C. | 图3表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a | |
| D. | 图4表示常温下向体积为10 mL0.1 mol/LNaOH溶液中逐滴加入0.1 mol/LCH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 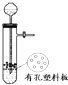 图所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 图所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| B. | 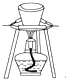 图所示装置用于除去碳酸氢钠固体中的少量碳酸钠 图所示装置用于除去碳酸氢钠固体中的少量碳酸钠 | |
| C. | 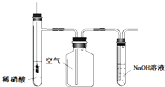 图所示装置用于制备并收集NO气体 图所示装置用于制备并收集NO气体 | |
| D. | 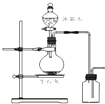 图所示装置制取并收集氨气 图所示装置制取并收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
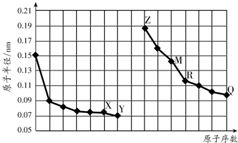
| A. | R在周期表的第15列 | |
| B. | 简单离子的半径:X>Z>M | |
| C. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学式 | HCOOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com