
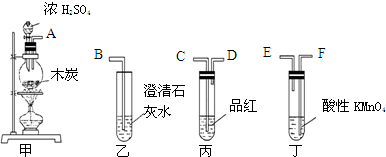
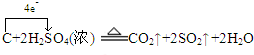 .
.分析 (1)验证木炭可被浓H2SO4氧化成CO2,由装置可知,甲中发生C与浓硫酸反应生成二氧化碳、二氧化硫,先用丙检验有二氧化硫生成,然后通过丁除去二氧化硫,再通过丙,利用品红不褪色说明二氧化硫除尽,最后通过乙,石灰水变浑浊,说明有二氧化碳生成,据此连接装置;
(2)二氧化硫具有漂白性,二氧化碳遇到澄清石灰水变浑浊,据此解答;
(3)高锰酸钾具有氧化性,二氧化硫具有还原性,据此即可解答;
(4)碳与浓硫酸加热生成二氧化碳和二氧化硫、水,反应中碳化合价从0升高为+4价,硫从+6价降为+4价,据此分析解答;
(5)依据浓硫酸的特性吸水性、脱水性、强氧化性,以及浓硫酸的酸性解答.
解答 解:(1)验证木炭可被浓H2SO4氧化成CO2,由装置可知,甲中发生C与浓硫酸反应生成二氧化碳、二氧化硫,先用丙检验有二氧化硫生成,然后通过丁除去二氧化硫,再通过丙,利用品红不褪色说明二氧化硫除尽,最后通过乙,石灰水变浑浊,说明有二氧化碳生成,所以装置的连接顺序为:A接C,D接F,E接B,
故答案为:C;D;F;E;
(2)二氧化硫能使品红褪色,丁装置用高锰酸钾酸性溶液除SO2,再通过丙中的品红溶液不褪色,则证明二氧化硫已经除尽;乙中为澄清的石灰水,澄清的石灰水和二氧化碳反应变浑浊,若乙中澄清石灰水还变浑浊,则证明存在二氧化碳,
故答案为:溶液浑浊;品红未褪色;
(3)为了验证木炭可被浓H2SO4氧化成CO2,应先除去二氧化硫,丁中高锰酸钾酸性溶液的作用除二氧化硫,防止对二氧化碳的验证产生干扰,反应的离子方程式:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;
故答案为:吸收SO2;2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;
(4)碳与浓硫酸加热生成二氧化碳和二氧化硫、水,反应中碳化合价从0升高为+4价,硫从+6价降为+4价,用双线桥表示为: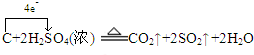 ;
;
故答案为: ;
;
(5)Ⅰ.浓硫酸可作SO2、CO2等气体的干燥剂,体现浓硫酸的吸水性,故选D;
Ⅱ.Na2CO3与H2SO4反应,依据强酸制备弱酸规律可知生成硫酸钠和二氧化碳和水,体现浓硫酸的酸性,故选B;
Ⅲ.向滤纸上滴加浓H2SO4,滤纸变黑,体现浓硫酸的脱水性,故选A;
Ⅳ.浓硫酸具有强的氧化性,能够使铝钝化,故选C:
故答案为:D;B;A;C.
点评 本题考查了浓硫酸氧化碳产物的检验,掌握浓硫酸的性质、二氧化硫的性质,注意对气体的验证方法,顺序、干扰的问题,题目难度中等.


科目:高中化学 来源: 题型:填空题
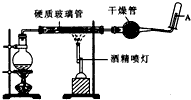 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”. 请回答该实验中的问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸或稀硫酸, 在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立, 溶液变成红色,则假设一不成立 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25 mL 0.5 mol•L-1HCl 溶液 | B. | 200 mL 0.25 mol•L-1 AlCl3溶液 | ||
| C. | 50 mL 1 mol•L-1 KCl 溶液 | D. | 100 mL 0.5 mol•L-1 MgCl2 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2属于碱性氧化物 | |
| B. | 酸雨是pH小于7的雨水 | |
| C. | CO2、NO2或SO2都会导致酸雨的形成 | |
| D. | 大雾是一种胶体,能发生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com