
| A. | 0.1mol/L NaHCO3溶液,c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| B. | 0.1mol/L K2S溶液中,c(K+)=c(S2-)+c(HS-)+c(H2S) | |
| C. | 常温时pH=2的盐酸和pH=12的氨水中由水电离出的c(H+)相等 | |
| D. | pH=3的盐酸和pH=11的氨水等体积混合完全反应后c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
分析 A.常温下,0.1mol•L-1NaHCO3溶液中HCO3-水解程度大于电离程度导致溶液呈碱性,但其水解和电离程度都较小,水还电离生成OH-,Na+不水解,据此判断离子浓度大小;
B.溶液中存在物料守恒,n(K)=2n(S);
C.常温时pH=2的盐酸溶液中氢离子浓度和pH=12的氨水中氢氧根离子浓度相同,对水的电离抑制程度相同;
D.pH=3的盐酸和pH=11的氨水等体积混合完全反应氨水溶液中一水合氨又电离出氢氧根离子,溶液显碱性,铵根离子浓度大于氯离子浓度.
解答 解:A.1mol•L-1NaHCO3溶液中HCO3-水解程度大于电离程度导致溶液呈碱性,但其水解和电离程度都较小,水还电离生成OH-,Na+不水解,则离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),故A错误;
B.0.1mol/L K2S溶液中存在物料守恒,c(K+)=2c(S2-)+2c(HS-)+2c(H2S),故C错误;
C.常温时pH=2的盐酸溶液中氢离子浓度和pH=12的氨水中氢氧根离子浓度相同,对水的电离抑制程度相同,由水电离出的c(H+)相等为10-2mol/L,故C正确;
D.pH=3的盐酸和pH=11的氨水等体积混合完全反应氨水溶液中一水合氨又电离出氢氧根离子,溶液显碱性,铵根离子浓度大于氯离子浓度,溶液中离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了电解质溶液中离子浓度大小、电解质溶液中电荷守恒、物料守恒、弱电解质电离平衡影响因素等知识,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,K+、OH-、S2-、NO3-能大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,离子方程式为:2Fe2++ClO-+2H+→Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
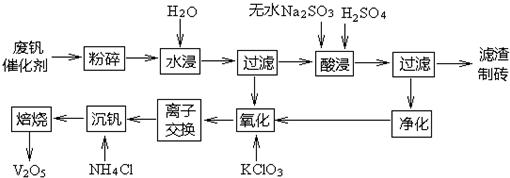
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
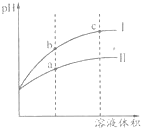 某温度下pH=2的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.下列说法正确的是( )
某温度下pH=2的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | Ⅱ为盐酸稀释时pH变化曲线 | |
| B. | b点溶液的导电性比c点溶液的导电性强 | |
| C. | a点Kw数值比c点Kw数值大 | |
| D. | pH=2的盐酸和醋酸,盐酸的物质的量浓度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人体不能缺碘,需要正常补碘.“加碘食盐”中的“碘”是指碘元素 | |
| B. | 进行焰色反应实验时,蘸取样品之前需要用稀硫酸溶液清洗铂丝 | |
| C. | “绿色化学”的理想在于不再使用有毒、有害的物质,不再产生废物 | |
| D. | 水壶中产生的水垢可用食醋清洗除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下11.2LNO2分子 | B. | 0.3mol H2SO4分子 | ||
| C. | 1L 0.5mol/LBa(OH)2溶液 | D. | 12.04×1023个SO3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| B. | 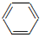 +HO-Na2$→_{60℃}^{浓硫酸}$ +HO-Na2$→_{60℃}^{浓硫酸}$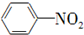 +H2O +H2O | |
| C. | CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3-CH2OH | |
| D. | CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和②产物的阴阳离子个数比相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数相同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 25℃、101kPa下:Na2O2(s)+2Na(s)=2Na2O(s)△H=-317kJ.mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com