
| 化学犍 | O=O | C=0 | C≡O |
| 键能(kJ•mol-1) | 497 | 803 | 1072 |
分析 反应焓变=反应物总键能-生成物总键能;
①N2(g)+O2(g)?2NO(g);
②2NO(g)+2CO(g)?2CO2(g)+N2(g);
①+②得:③2CO(g)+O2(g)?2CO2(g),依据反应焓变=反应物总键能-生成物总键能计算该反应的焓变;
依据盖斯定律②=③-①计算2NO(g)+2CO(g)?2CO2(g)+N2(g)△H.
解答 解:二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为 ;结构式为O=C=O,图表中的C≡O为CO,反应焓变=反应物总键能-生成物总键能,①N2(g)+O2(g)?2NO(g);
;结构式为O=C=O,图表中的C≡O为CO,反应焓变=反应物总键能-生成物总键能,①N2(g)+O2(g)?2NO(g);
②2NO(g)+2CO(g)?2CO2(g)+N2(g);
①+②得:③2CO(g)+O2(g)?2CO2(g),则③2CO(g)+O2(g)?2CO2(g),反应焓变=反应物总键能-生成物总键能计算该反应的焓变,根据图表中的数据可知△H3=497+2×1072-803×4=-571kJ/mol;
依据盖斯定律:③2CO(g)+O2(g)?2CO2(g)△H3=-571kJ/mol;
①N2(g)+O2(g)?2NO(g)△H=+180kJ/mol;
则③-①得:②2NO(g)+2CO(g)?2CO2(g)+N2(g),则其焓变值△H2=△H3-△H1=-571-180=-751kJ/mol;
故答案为:-751.
点评 本题考查反应热的计算,需注意C≡O为CO,熟练应用盖斯定律以及熟悉各反应物的结构是解答关键,题目难度中等.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:选择题
| A. | “地沟油”可以制成肥皂,提高资源的利用率 | |
| B. | 为防止食品氧化变质,常在食品包装袋中放入生石灰 | |
| C. | 用加热灼烧的方法可以区分羊毛毛线和腈纶毛线 | |
| D. | 加快开发髙效洁净能源转换技术,缓解能源危机 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
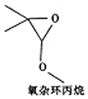
| A. | 该有机物的分子式为C5H9O2 | |
| B. | 该有机物能与金属钠反应 | |
| C. | 该有机物的同分异构体(不考虑立休异构)中,能水解生成羧酸与醇的物质共有9种 | |
| D. | 该有机物的同分异构体(不考虑立体异构)中,属于羧酸的物质共有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
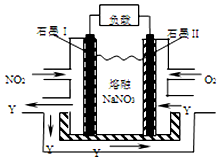 汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.
汽车尾气中的NOx是大气污染物之一,用CH4催化还原NOx可以消除氮氧化物的污染.| 实验编号 | 温度 | 0分钟 | 10分钟 | 20分钟 | 40分钟 | 50分钟 | |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域.
由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
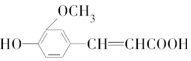 ,符合下列条件的阿魏酸的同分异构体的数目为
,符合下列条件的阿魏酸的同分异构体的数目为| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升降机的Al-Mg合金焊接过程中,可采用N2作保护气 | |
| B. | 为降低舰体钢材料中硅含量,冶炼过程中需使用O2和CaCO3 | |
| C. | 为测定螺旋浆Cu-Al合金中铜元素含量,只需使用氨水 | |
| D. | 为防止舰体在海水中发生电化学腐蚀,可镶嵌铜块 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2溶于水:C12+H2O?2H++Cl-+C1O- | |
| B. | 用稀硝酸除去试管内壁的银镜:Ag+4H++NO3-═Ag++NO↑+2H2O | |
| C. | 过量SO2通入饱和的Ca(C1O)2溶液中:Ca2++2ClO-+2SO2+2H2O═CaSO4↓+SO42-+4H++2Cl- | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液并加热:NH4++Fe2++3OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Fe(OH)2↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com