
分析 一定温度下,1L密闭容器中加入amolSO2、bmolO2,反应达平衡时有cmolSO2发生了反应,则
2SO2+O2?2SO3,
起始量(mol)a b 0
转化量(mol)c 0.5c c
平衡量(mol)a-c b-0.5c c
(1)根据方程式计算生成三氧化硫的物质的量;
(2)氧气转化率=$\frac{参加反应的n({O}_{2})}{反应初始n({O}_{2})}$×100%;
(3)平衡时容器内气体总物质的量等于剩余的二氧化硫、氧气和生成的三氧化硫的物质的量之和;
(4)根据c=$\frac{n}{V}$计算平衡时各物质的物质的量浓度.
解答 解:一定温度下,1L密闭容器中加入amolSO2、bmolO2,反应达平衡时有cmolSO2发生了反应,则
2SO2+O2?2SO3,
起始量(mol)a b 0
转化量(mol)c 0.5c c
平衡量(mol)a-c b-0.5c c
(1)根据方程式知,生成n(SO3)等于参加反应的n(SO2)为cmol,
故答案为:c;
(2)氧气转化率=$\frac{参加反应的n({O}_{2})}{反应初始n({O}_{2})}$×100%=$\frac{0.5cmol}{bmol}$×100%=$\frac{50c}{b}$%,
故答案为:$\frac{50c}{b}$%;
(3)平衡时容器内气体总物质的量等于剩余的二氧化硫、氧气和生成的三氧化硫的物质的量之和=(a-c+b-0.5c+c)mol=(a+b-0.5c)mol,
故答案为:(a+b-0.5c)mol;
(4)达到平衡时,c(SO2)=$\frac{a-c}{1}$mol/L=(a-c)mol/L,c(O2)=$\frac{b-0.5c}{1}$mol/L=(b-0.5c)mol/L,c(SO3)=$\frac{c}{1}$mol/L=cmol/L,
故答案为:a-c;b-0.5c; c.
点评 本题考查化学平衡有关计算,侧重考查学生分析计算能力,利用“三段式”法分析解答即可,题目难度不大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 滴加过程中,当溶液的pH=7时,溶液中2c(NH4+)=c(SO42-) | |
| B. | 滴加过程中,当溶液中c(Cu2+)=2.2×10-2 mol/L时,溶液的pH=9 | |
| C. | 若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积小于V | |
| D. | 若将氨水加水稀释,则稀释过程中,$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$始终保持增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
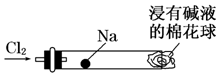 “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的实验.实验操作:钠与氯气反应的装置可作如右图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中错误的是( )
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的实验.实验操作:钠与氯气反应的装置可作如右图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中错误的是( )| A. | 反应生成的大量白烟是氯化钠晶体 | |
| B. | 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 | |
| C. | 钠着火燃烧产生苍白色火焰 | |
| D. | 发生的反应为2Na+Cl2═2NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 | B. | 0.05 | C. | 0.04 | D. | 0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 氢氧化钡溶液与稀H2SO4 反应:H++SO42-+Ba2++OH-=H2O+BaSO4↓ | |
| C. | 纯碱与醋酸溶液反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 氧化铜溶于稀硫酸:CuO+2H+=Cu2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2gH2含有的氢原子数目为NA | |
| B. | 1L1mol•L-1KOH溶液中含有的钾离子数目为NA | |
| C. | 1molZn完全变为Zn2+失去的电子数目为NA | |
| D. | 常温常压下,22.4LO2含有的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 移液前容量瓶中有少量蒸馏水 | |
| C. | 在容量瓶中进行定容时俯视刻度线 | |
| D. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收 a kJ |
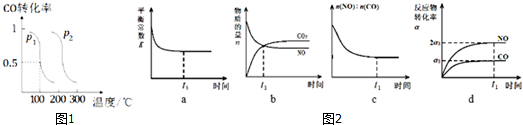
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com