
一定温度下在容积恒定的密闭容器中,进行反应A(s)+2B(g)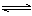 C(g)+D(g),当下列物理量不发生变化时,能说明该反应已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时,能说明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体总物质的量 ④B的物质的量浓度
A.①④ B.只有②③ C.②③④ D.只有④
科目:高中化学 来源: 题型:
二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
Ⅰ(1)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。
电池的正极反应式为________________________________
Ⅱ某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(2)在第②步中,将上述固体与浓盐酸混合的目的是________________________________
(3)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式:
_______________________________________
Ⅲ 湿法炼锰即电解硫酸锰溶液法。电解锰的生产过程分为化合浸取、氧化净化及沉淀除杂、产品回收。其生产工艺流程如下:
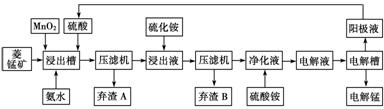
已知:①菱锰矿中主要成份是碳酸锰,主要杂质是Fe2+、Co2+、Ni2+。
②生成氢氧化物的pH如下表:(若某离子浓度小于等于10-5mol/L,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
③有关难溶氢氧化物和硫化物pKsp数据(pKsp=-lgKsp):
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
(4)菱锰矿粉与硫酸反应的化学方程式是________________________________。
(5)使用氨水的目的是调节pH值在________之间(填pH范围,精确到小数点后1位数字)。
在“浸出液”中加入(NH4)2S(硫化铵)的目的是_________________________________
(6)电解槽中使用的是惰性电极板,电解反应方程式为_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期金属元素甲~戊在元素周期表中的相对位置如表所示,下面判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中都是既有离子键又有共价键的一组是( )
A.NaOH、H2O、NH4Cl B.KOH、Na2O2、(NH4)2S
C.MgO、CaBr2、NaCl D.Na2SO4、HCl、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下:

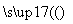

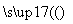

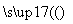
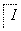
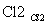
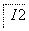
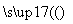
 ―→
―→
(1)实验操作①的名称是 ;实验操作③的名称是________ ,所用主要仪器名称为________。
(2)利用碘的有机溶液得到单质I2的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1 L某混合溶液中,溶质X、Y浓度都为0.1mol·L—1,向混合溶液中滴加0.1 mol·L—1某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是
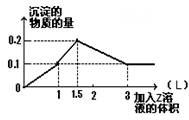
A.氯化铝、氯化镁、氢氧化钠 B.偏铝酸钠、氢氧化钡、硫酸
C.氯化铝、氯化铁、氢氧化钠 D.偏铝酸钠、氯化钡、硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
某植物净光合速率的变化趋势如图所示。据图回答下列问题:
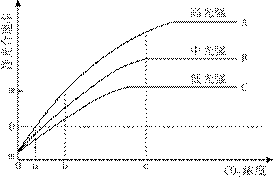
(1)光合作用暗反应阶段中C3的还原需要消耗光反应阶段所产生的 。
(2)当CO2浓度为a时,高光强下该植物的净光合速率为 。CO2浓度在a~b之间时,曲线 表示了净光合速率随CO2浓度的增高而增高。
(3)CO2浓度为c时,如果增加CO2浓度曲线B和C所表示的净光合速率将 (填“不变”“升高”“降低”)。
(4)当环境中CO2浓度小于a时,在图示的3种光强下,该植物呼吸作用产生的CO2量
(填“大于”、“等于”或“小于”)光合作用吸收的CO2量。
(5)当CO2浓度为b,中光强时,叶肉细胞产生ATP的场所有 ,此时如果适当增加光照强度, (填“C3”或“C5”)的含量将上升。
(6)据图可推测,在温室中,若要采取提高CO2浓度的措施来提高该种植物的产量,还应该同时考虑 这一因素的影响,并采取相应措施。
查看答案和解析>>
科目:高中化学 来源: 题型:
在同温同压下,下列各组热化学方程式中,△H1>△H2的是 ( )
A.2H2(g)+O2(g)==2H2O(g) △H1 2H2(g)+O2(g)==2H2O(l) △H2
B.S(g)+O2(g)==SO2(g) △H1 S(s)+O2(g)==SO2(g) △H2
C.C(s)+ 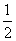 O2(g)==CO(g) △H1 C(s)+ O2(g)==CO2(g) △H2
O2(g)==CO(g) △H1 C(s)+ O2(g)==CO2(g) △H2
D.H2(g)+ Cl2(g)==2HCl(g) △H1 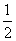 H2(g)+
H2(g)+ 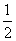 Cl2(g)==HCl(g) △H2
Cl2(g)==HCl(g) △H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com