
| A. | 80ml | B. | 120ml | C. | 150ml | D. | 200ml |
分析 Mg、Cu混合物与硝酸恰好反应生成Mg(NO3)2、Cu(NO3)2,部分硝酸被还原为NO气体,标况下0.896LNO气体的物质的量为:$\frac{0.896L}{22.4L/mol}$=0.04mol,根据电子守恒,Mg、Cu失去电子的物质的量为:0.04mol(5-2)=0.12mol,则反应后生成镁离子、铜离子的总物质的量为:$\frac{0.12mol}{2}$=0.06mol;向反应后的溶液中加入一定体积1mol•L-1的NaOH溶液恰好使金属离子沉淀完全,则氢氧化钠提供的氢氧根离子所带电荷与镁离子、铜离子所带电荷相等,据此可知氢氧化钠物质的量,再根据V=$\frac{n}{c}$计算出消耗氢氧化钠溶液的体积.
解答 解:Mg、Cu混合物与硝酸恰好反应生成Mg(NO3)2、Cu(NO3)2,部分硝酸被还原为NO气体,
标况下0.896LNO气体的物质的量为:$\frac{0.896L}{22.4L/mol}$=0.04mol,根据电子守恒,Mg、Cu失去电子的物质的量为:0.04mol(5-2)=0.12mol,则反应后生成镁离子、铜离子的总物质的量为:$\frac{0.12mol}{2}$=0.06mol,
向反应后的溶液中加入一定体积1mol•L-1的NaOH溶液恰好使金属离子沉淀完全,则氢氧化钠提供的氢氧根离子所带电荷与镁离子、铜离子所带电荷相等,则氢氧化钠的物质的量为:0.06mol×2=0.12mol,
消耗1mol•L-1的NaOH溶液的体积为:$\frac{0.12mol}{1mol/L}$=0.12L=120mL,
故选B.
点评 本题考查混合物反应的计算,题目难度中等,判断金属提供电子等于氢氧根的物质的量是解题关键,注意守恒思想在化学计算中的应用方法.


科目:高中化学 来源: 题型:填空题
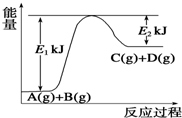 已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
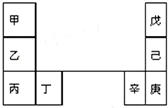 甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )
甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 丙与庚的原子核外电子数相差14 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当c(Cu2+)=c(Mn2+)时该反应达到平衡 | |
| B. | 从该反应原理可以得出CuS的溶解度比MnS的溶解度大 | |
| C. | 该反应的平衡常数K=$\frac{{K}_{sp}(MnS)}{{K}_{sp}(CuS)}$ | |
| D. | 往平衡体系中加入少量CuSO4(s)后,c( Mn2+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比($\frac{{P}_{后}}{{P}_{前}}$) | 0.98 | 0.90 | 0.78 | 0.66 | 0.66 | 0.66 |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | SO42-、Fe2+、NO3-、K+ | K3[Fe(CN)6] | 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ |
| B | Na+、Fe3+、I-、ClO- | HCl | ClO-+H+=HClO |
| C | Ba2+、Al3+、Cl-、H+ | 少量NaOH | Al3++3OH-=Al(OH)3↓ |
| D | S2O32-、Na+、Cl-、SO32-、K+ | 过量硫酸 | 2S2O32-+2H+=SO42-+3S↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、D、E、A、B | B. | E、C、D、A、B | C. | B、A、D、C、E | D. | B、A、E、D、C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸性溶液中:NH4+、K+、CO32-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 加入铝粉能放出氢气的溶液中:K+、Ba2+、Cl-、Br- | |
| D. | 在强碱性的溶液中:NH4+、Na+、Cl-、H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com