

分析 (1)往Al2(SO4)3溶液中加入一定量CaO粉末和蒸馏水,可生成碱式硫酸铝Al2(SO4)3•Al2O3,同时析出生石膏沉淀[CaSO4•2H2O],根据质量守恒配平即可;
(2)碱式硫酸铝溶液与含有二氧化硫的烟气在在恒温40~60oC反应Al2(SO4)3•Al2O3(aq)+3SO2(g)?Al2(SO4)3•Al2(SO3)3(aq)△H<0,得到Al2(SO4)3•Al2(SO3)3溶液,对该溶液恒温98℃,溶液分解得到二氧化硫和碱式硫酸铝溶液,
①根据反应的热效应分析可得;
②由图2可知,碱式硫酸铝中的活性Al2O3含量不同时,酸度计测定不同参数的吸收液的pH有变化,说明SO2的结合方式是与活性Al2O3结合,pH相同时,活性Al2O3吸收越多SO2,则y>x>z;
③Al2(SO4)3•Al2(SO3)3溶液恒温98℃,溶液分解得到III中得到再生的碱式硫酸铝溶液,分解过程中部分Al2(SO3)3被氧化为Al2(SO4)3,其n(Al2O3):n[Al2(SO4)3]比值相对I中有所下降;
(3)①电极b为空气中氧气放电结合氢离子的反应,氢离子浓度减小,pH增大;
②电极a为二氧化硫放电失电子发生的氧化反应.
解答 解:(1)往Al2(SO4)3溶液中加入一定量CaO粉末和蒸馏水,可生成碱式硫酸铝Al2(SO4)3•Al2O3,同时析出生石膏沉淀[CaSO4•2H2O],化学方程式为:2Al2(SO4)3+3CaO+6H2O=Al2(SO4)3•Al2O3+3CaSO4•2H2O;
故答案为:2Al2(SO4)3+3CaO+6H2O=Al2(SO4)3•Al2O3+3CaSO4•2H2O;
(2)①碱式硫酸铝吸收SO2的反应为放热反应,降温使平衡正向移动,有利于SO2的吸收,生产中常控制脱硫液在恒温40~60oC;
故答案为:碱式硫酸铝吸收SO2的反应为放热反应,降温使平衡正向移动,有利于SO2的吸收;
②由图2可知,碱式硫酸铝中的活性Al2O3含量不同时,酸度计测定不同参数的吸收液的pH有变化,说明SO2的结合方式是与活性Al2O3结合,pH相同时,活性Al2O3吸收越多SO2,则y>x>z;
故答案为:与活性Al2O3结合;y>x>z;
③Al2(SO4)3•Al2(SO3)3溶液恒温98℃,溶液分解得到III中得到再生的碱式硫酸铝溶液,分解过程中部分Al2(SO3)3被氧化为Al2(SO4)3,2Al2(SO3)3+3O2=2Al2(SO4)3或2[Al2(SO4)3•Al2(SO3)3]+3O2=4Al2(SO4)3,其n(Al2O3):n[Al2(SO4)3]比值相对I中有所下降;
故答案为:2Al2(SO3)3+3O2=2Al2(SO4)3或2[Al2(SO4)3•Al2(SO3)3]+3O2=4Al2(SO4)3;
(3)①电极b为空气中氧气放电结合氢离子的反应,氢离子浓度减小,pH增大;
故答案为:变大;
②电极a为二氧化硫放电失电子发生的氧化反应,电极反应式为:SO2-2e-+2H2O=4H++SO42-;
故答案为:SO2-2e-+2H2O=4H++SO42-.
点评 本题以物质制备为载体,考查学生对原理的分析理解、物质的分离提纯、氧化还原反应、信息获取与迁移运用、原电池的相关原理等,需要学生具备扎实的基础,对提米信息理解透彻,题目难度较大.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
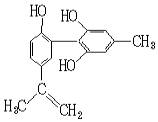 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 有机物分子式为C16H14O3 | |
| B. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| C. | 1 mol该物质分别与浓溴水、H2反应时最多消耗Br2和H2分别为4 mol、7 mol | |
| D. | 滴入KMnO4(H+)溶液,观察紫色褪去,可证明结构中存在碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
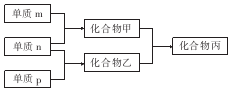 短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )
短周期主族元素X、Y、Z的单质m、n、p在通常状况下均为气态,并有下列转化关系(反应条件略去):其中双原子单质分子中,单质m含共用电子对数最多,甲含有10电子,乙含有18电子.下列说法正确的是( )| A. | X是同周期中非金属性最强的元素 | |
| B. | 元素X、Y、Z的原子半径大小关系为X<Y<Z | |
| C. | Z的氧化物的水化物的酸性在主族元素中最强 | |
| D. | 化合物丙是离子化合物,既含离子键又含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
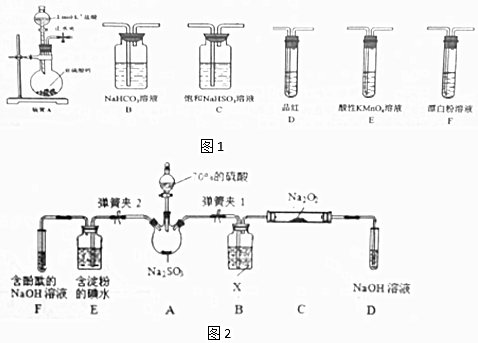
| 操作步骤 | 实验现象 | 解释原因 |
| 关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①Na2O2+SO2=Na2SO4 |
| 若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2═2Na2SO3+O2 | |
| 关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中. | E中②E 中溶液蓝色褪去 | E中反应的离子方程式③SO2+I2+2H2O=2I-+SO42-+4H+ |
| F中④F 中红色变浅或褪色 | F中反应为2OH-+SO2═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+2 | B. | a+8 | C. | a+26 | D. | a+18 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H<-38.6 kJ•mol-1 | |
| B. | 中和热的测定实验中需要用的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒,也可以用保温杯代替烧杯做有关中和热测定的实验 | |
| C. | 在测定中和热的实验中,至少需要测定并记录的温度是3次 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com