
【题目】能够说明在恒温恒容下的密闭容器中,反应2SO2+O2![]() 2SO3,已达平衡状态的标志是
2SO3,已达平衡状态的标志是
A. SO2和SO3的物质的量浓度相等
B. 反应容器内气体的密度不随时间变化而变化
C. 单位时间内生成2mol SO3时,同时生成lmolO2
D. 容器中SO2、O2、SO3的物质的量之比为2:l:2
科目:高中化学 来源: 题型:
【题目】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用。
(1)写出基态B原子的轨道表达式___________________。
(2)三价B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为___________________ (标出配位键),其中心原子的杂化方式为式________,写出[BH4]-的两种等电子体________________。
(3)图1表示多硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数)。

(4)硼酸晶体是片层结构,图2表示的是其中一层的结构。层间存在的作用力有_________________;硼酸晶体在冷水中溶解度很小,但在热水中较大,原因是_____________________。
(5)三氯化硼的熔点比氯化镁的熔点低,原因是_________________________________________。
(6)镁属六方最密堆积(图3),其晶胞结构如图4所示,若镁原子半径为apm,则镁晶体的密度为_________________________________g/cm3(用含a的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[化学式:Sr(NO3)2]用于制造信号灯、光学玻璃等。
Ⅰ.工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,向其中加入浓HNO3溶解,搅拌。
②过滤,并用浓HNO3洗涤滤渣。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH至7~8,过滤。
④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
(1)步骤②用浓HNO3洗涤滤渣的目的是_________。
(2)步骤③中肼(N2H4)将过量铬酸(CrO3)还原为Cr3+,同时产生一种无色无味的气体,写出该反应的离子方程式_______________。
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等,除去100L锅炉水(含氧气8g/L)的溶解氧,需要肼的质量为_________。
Ⅱ.Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500 ℃时Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到5.20 g SrO固体和5.08 g混合气体。计算该样品中Sr(NO3)2的质量分数(写出计算过程)_________(精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.将等质量的Cu片、Zn片放入盛有1L稀硫酸溶液的烧杯中,用导线连接形成原电池。如下图所示:
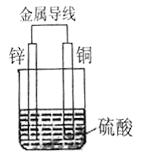
①原电池的负极材料是_____,(填“名称”)
铜片上发生反应的类型是_____反应(填“氧化”或“还原”)
②一段时间内,当电路中有2mol的电子发生转移时,理论上该装置中可收集气体___L(标准状况)
II. 一定温度下,在2L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示
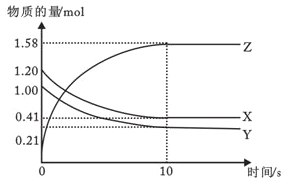
(1)反应从开始到10s时,用Y的浓度变化来表示的反应速率为__________
(2)该反应的化学方程式为:______________
(3)在恒温恒容的密闭容器中,当下列物理量不再发生变化时,一定可以作为上述反应达到平衡的标志是____________
①混合气体的压强 ②混合气体的密度 ③混合气体的总物质的量 ④相同时间内,X消耗的物质的量与Z消耗的物质的量之比为1:2 ⑤各物质表示的反应速率之比等于化学计量数之比 ⑥混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同族元素所形成的同一类型的化合物,其结构和性质往往相似。化合物PH4I是一种白色晶体,下列对它的描述中正确的是( )
A. 它是一种共价化合物 B. 在加热时此化合物可以分解为PH3和HI
C. 这种化合物不能跟碱反应 D. 该化合物不易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计出一种装置(电解质溶液呈碱性),总反应为2CO2=2CO+O2。

(1)该装置实现了_______________(填“太阳能”“电能”“化学能”,下同)转化为_____________,最终转化为__________。
(2)x极发生了__________反应(填“氧化”或“还原”)Y极的电极反应:__________。
(3)反应完毕,该装置中的电解质溶液碱性__________ (填“增强”、“减弱”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到如下信息:
①将干燥的氯气在110℃~140℃与硫反应,即可得S2Cl2粗品。
②有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
S | 112.8 | 444.6 | 略 |
S2Cl2 | -77 | 137 |
S2Cl2+Cl2 2SCl2 |
设计实验装置图如下:

(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见 。利用改进后的正确装置进行实验,请回答下列问题:
(2)B中反应的离子方程式: 。E中反应的化学方程式: 。
(3)C中的试剂是 。
(4)仪器B的名称是 。F的作用是 。
(5)如果在加热E时温度过高,对实验结果的影响是 。
(6)S2Cl2粗品中可能混有的杂质是(填写两种) ,为了提高S2Cl2的纯度,关键的操作是控制好温度和 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是植物(特别是草本植物)常具有的成分,具有广泛的用途。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)拟用下列装置分解草酸制备少量纯净的CO,其合理的连接顺序为___________(填字母序号)。

![]()

(2)相同温度条件下,分别用3支试管按下列要求完成实验:
试管 | A | B | C |
加入试剂 | 4mL 0.01mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.02mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 | 4mL 0.03mol/L KMnO4 1ml 0.1moL/L H2SO4 2mL 0.1mol/L H2C2O4 |
褪色时间 | 28秒 | 30秒 | 不褪色 |
写出试管B的离子方程式_____________________________________;上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快”?____________(选填“能”或“不能”);简述你的理由:__________________________________。
(3)设计实验证明草酸为弱酸的方案及其现象均正确的有_____________(填序号)。
A.室温下,取0.010mol/L的H2C2O4溶液,测其pH=2;
B.室温下,取0.010mol/L的NaHC2O4溶液,测其pH >7;
C.室温下,取pH=a(a<3)的H2C2O4溶液稀释100倍后,测其pH< a+2;
D.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL;
(4)为测定某H2C2O4溶液的浓度,取20.00mL H2C2O4溶液于锥形瓶中,滴入2-3滴指示剂,用0.1000mol/L的NaOH溶液进行滴定,并进行3次平行实验,所用NaOH溶液体积分别为19.98mL、20.02mL和22.00mL。
①所用指示剂为_______________;滴定终点时的现象为_________________________;
②H2C2O4溶液物质的量浓度为_______________;
③下列操作会引起测定结果偏高的是__________(填序号)。
A. 滴定管在盛装NaOH溶液前未润洗
B. 滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C. 滴定前读数正确,滴定终点时俯视读数
D. 滴定前读数正确,滴定终点时仰视读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com