
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.NaClO溶液具有碱性,可用于杀菌消毒
B.NH3具有还原性,可用于检验HCl泄漏
C.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板
D.漂白粉在空气中不稳定,可用于漂白纸浆
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
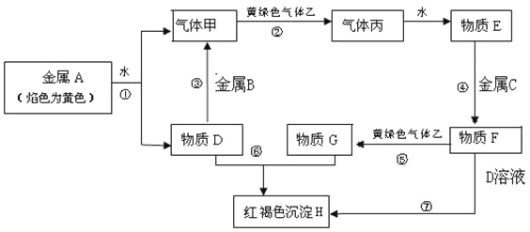
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A_______、F________、H________。
(2)反应过程⑦可能观察到的实验现象______,反应的化学方程式为④_________。
(3)反应⑤的离子方程式为__________。
(4)反应①-⑦的7个反应属于氧化还原反应反应的有 ________(填选项代号)。
A.①②④⑤⑥ B.②③④⑥⑦ C.①②③④⑤⑦ D.全部
(5)向纯碱溶液中通入气体乙,可制得某种生产生活中常用的漂白、消毒的物质,同时有小苏打生成。该反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g)2HI(g)△H=-akJ/mol,已知: (a、b、c均大于零)
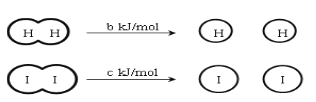
下列说法正确的是
A.碰撞理论认为,反应速率的大小与单位时间内反应物微粒间碰撞次数成正比,只要有足够的能量就可以发生有效碰撞
B.断开2molHI分子中的化学键所需能量约为(c+b+a)kJ
C.相同条件下,1molH2(g)和1molI2(g)总能量小于2molHI(g)的总能量
D.向密闭容器中加入2molH2(g)和2molI2(g),充分反应后放出的热量为2akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业利用含镍废料(以镍铁钙合金为主)制取NiC2O4(草酸镍),再经高温煅烧NiC2O4制取Ni2O3的流程如图:
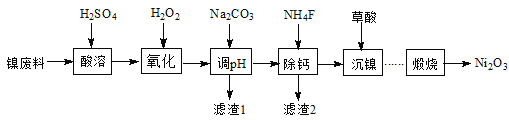
已知:NiC2O4、CaC2O4均难溶于水;Fe3+完全沉淀的pH约为3.2。
(1)“酸溶”时硫酸不宜过多的原因为________。
(2)加入H2O2发生的主要反应的离子方程式为________;
(3)加入Na2CO3溶液调节pH至4.0~5.0,其目的为_________。
(4)加入NH4F溶液可将Ca2+转化为CaF2沉淀除去,已知25℃时Ksp(CaF2)=1.6×10-10,要使溶液中Ca2+沉淀完全[c(Ca2+)≤1.0×10-5 mol·L-1],则“除钙”时需控制NH4F的浓度至少为_______mol·L-1。
(5)NiC2O4隔绝空气高温煅烧可制得Ni2O3,NiC2O4受热分解的化学方程式为_____。
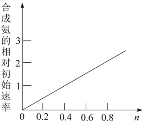
(6)Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时,合成氨的相对初始速率随催化剂中n值变化的曲线如图,由图可知Co2+、Ni2+两种离子中催化效果更好的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由CuO和KHC2O4溶液反应的到的蓝色结晶[KaCub(C2O4)cdH2O]。为测定其组成,进行了如下实验:
步骤1称取3.5400 g该晶体,加入过量稀硫酸,待样品完全溶解后加入适量水,配制成100 mL溶液A.
步骤2量取20.00 mLA溶液,滴加0.2000 mol L-1 KMnO4溶液至恰好完全反应时,消耗KMnO4溶液8.00 mL。
步骤3另取20.00 mLA溶液,加入足量NaOH溶液,充分反应后,经过滤、洗涤、灼烧、称重,得到黑色固体粉末0.16 g。
己知:步骤2 中发生反应:2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ +10CO2↑ + 8H2O。
(1)步骤1中配制溶液A时,需要用到的玻璃仪器有烧杯、玻璃棒、_____。
(2)3.5400 g 该样品中含 n(C2O42-)= ____mol。
(3)3.5400 g 该样品中含 n(Cu2+)= ____mol。
(4)通过计算确定该蓝色晶体的化学式__________(计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是( )
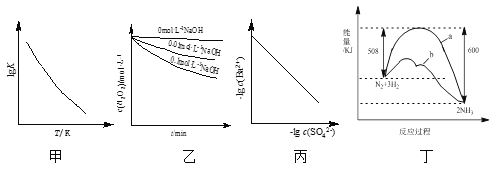
A.图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的lgK与反应温度T的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的lgK与反应温度T的关系曲线,说明该反应的ΔH<0
B.图乙是70℃时不同pH条件下H2O2浓度随时间的变化曲线。说明其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO![]() )的关系曲线,说明溶液中c(SO
)的关系曲线,说明溶液中c(SO![]() )越大c(Ba2+)越小
)越大c(Ba2+)越小
D.图丁是合成氨反应过程中能量变化曲线,说明该反应为放热反应,且b表示在反应体系中加入了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1g氢气在氧气中燃烧生成液态水,放出142.9kJ的热量,表示该反应的热化学方程式是()
A.H2(g)+![]() O2 (g)=H2O(l) △H=-285.8kJ·mol-1
O2 (g)=H2O(l) △H=-285.8kJ·mol-1
B.H2(g)+![]() O2 (g)=H2O(g) △H=-285.8kJ·mol-1
O2 (g)=H2O(g) △H=-285.8kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) △H=-285.8kJ
D.H2+![]() O2=H2O △H=-285.8kJ·mol-1
O2=H2O △H=-285.8kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中常常需要对混合气体中的NOx含量进行测定,其中一种方法的操作如下:①将200L气样通入酸化的H2O2溶液中,使NOx完全被氧化为NO![]() ,加水稀释至100.00mL;②微微加热,除去过量的H2O2;③量取20.00mL该溶液,加入20mL8.000×10-2mol·L-1FeSO4溶液(过量),充分反应;④用5.000×10-3mol·L-1K2Cr2O7溶液滴定剩余的Fe2+,终点时消耗20.00mL。
,加水稀释至100.00mL;②微微加热,除去过量的H2O2;③量取20.00mL该溶液,加入20mL8.000×10-2mol·L-1FeSO4溶液(过量),充分反应;④用5.000×10-3mol·L-1K2Cr2O7溶液滴定剩余的Fe2+,终点时消耗20.00mL。
(1)能使气样中的NOx更好地被H2O2溶液氧化的操作是___。
(2)NO被H2O2氧化为NO3-的离子方程式是___。
(3)若缺少步骤②,对混合气体中NOx含量的测定结果将___(填“偏大”或“偏小”或“无影响”)。
(4)滴定过程中发生下列反应(未配平):
Fe2++NO![]() +H+——NO↑+Fe3++H2O
+H+——NO↑+Fe3++H2O
Cr2O![]() +Fe2++H+——Cr3++Fe3++H2O
+Fe2++H+——Cr3++Fe3++H2O
则气样中NOx折合成NO2的含量为___mg·m-3。(保留4位有效数字)(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】JohnB.Goodenough等三位科学家因为在锂离子电池研究领域的突出贡献获得2019年诺贝尔化学奖。碳酸锂是一种常见的锂离子电池原料,一种以锂辉石为原料制取碳酸锂的工艺如图:(锂辉石:LiAl(SiO3)2,也表示为Li2O·Al2O3·4SiO2,还含微量的钠、钙、镁等元素)
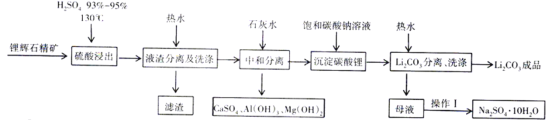
[查阅资料]:Li2CO3为无色单斜晶系结晶体,熔点618℃,溶于硫酸,微溶于水,在冷水中的溶解度比热水中大。
(1)在“硫酸浸出”流程,将硫酸加热到130℃的目的是___________________________。
(2)工业上高温煅烧FePO4、Li2CO3和草酸晶体(H2C2O4·2H2O)的混合物制取电池材料磷酸亚铁锂(LiFePO4),反应的化学方程式为__________________________________。
(3)LiFePO4含有Fe、Li两种金属元素,它们的焰色反应的颜色分别是___________
A.黄色、紫红色B.绿色、黄色C.无焰色反应、紫红色D.黄色、无焰色反应
(4)在“Li2CO3分离、洗涤”流程,用热水洗涤的原因是___________________________。
(5)某浓差电池的原理示意如图所示,可用该电池从浓缩海水中提取LiCl溶液。
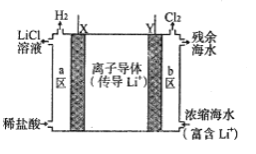
电池中的Y电极为________(填“正极”或“负极”或“阳极”或“阴极”)。X极的电极反应方程式为:________________________________________________。Y极每生成标况下22.4LCl2,有_________molLi+经过离子导体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com