
【题目】能证明微量元素是生命活动所必需的是下列哪项( )
A. Mg是叶绿素的组成成分
B. 哺乳动物血液中Ca2+含量太低,会抽搐
C. 油菜缺少B时只会开花不结果
D. Ca2+缺少时,会影响骨髓的发育
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】1,4﹣环己二醇可通过下列路线合成(某些反应的反应物和反应条件未列出): 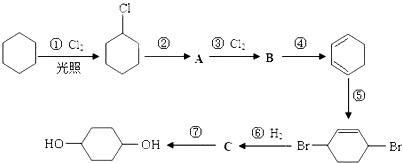
(1)写出反应④、⑦的化学方程式:④; ⑦ .
(2)②的反应类型是 , 上述七个反应中属于加成反应的有(填反应序号).
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.不需要加热就能发生的反应是放热反应
B.构成原电池正极和负极的材料必须是两种金属
C.化学能是能量的一种形式,它不仅可以转化为热能,也能转化为电能
D.马口铁(镀锡铁)破损时与电解质溶液接触,锡先被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:
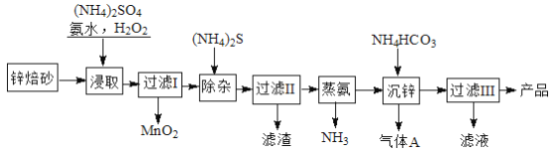
请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42-)时,溶液呈___________ (填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是__________________(任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为____________________________。
(4)“沉锌”的离子方程式为__________________________________。
(5)“过滤III”所得滤液可循环使用,其主要成分的化学式是__________________。
(6)己知:HCN的电离常数Ka=4.9×10 -10, H2S 的电离常数Ka1=1.3×10 -7,Ka2=7.0×10 -15,向NaCN 溶液中通入少量的H2S 气体,反应的离子方程式为______________________________________。在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 molL-1Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.0×10 -4molL-1时,Mn2+开始沉淀,则a=____________。[已知: Ksp(MnS)=1.4×10 -15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和 铜片中无杂质,气体体积已转换为标准状况。下列说法正确的是 ( )

A. a 电极的电极材料是铜
B. 如果将稀硫酸换为 CuSO4 溶液,则不能达到实验目的
C. 锌与稀硫酸反应时放出的热量对实验测定不产生影响
D. 若量筒中收集到 a L H2,则电解质溶液中通过了![]() mol 电子
mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池,电池总反应为:V2O5+xLi![]() LixV2O5。下列说法中正确的是
LixV2O5。下列说法中正确的是
A.锂在放电时做正极材料,充电时为阳极材料
B.电池在放电时,Li+向负极移动
C.该电池充电时阳极的反应为:LixV2O5 -xe-=V2O5 + xLi+
D.V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是
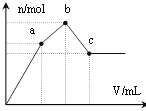
A. a点的溶液呈中性
B. 从开始到b点发生反应的总的离子方程式是:Al3++2SO42-+2Ba2++3OH-= Al(OH)3↓+2BaSO4↓
C. c点加入Ba(OH)2溶液的体积为200 mL
D. c点溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3BO3(一元弱酸) 可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是

A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
D. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol Fe,充分反应(已知NO![]() 被还原为NO),最终溶液体积为1L。下列说法正确的是( )
被还原为NO),最终溶液体积为1L。下列说法正确的是( )
A. 反应后生成NO的体积为33.6 L (标况)
B. 所得溶液中c(Fe2+)∶c(Fe3+)=1∶2
C. 所得溶液中c(NO![]() )=2.75 mol·L-1
)=2.75 mol·L-1
D. 所得溶液中的溶质只有FeSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com