
| A. | C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol | B. | 2SO2(g)+O2(g)=SO3(g)△H=-196.6kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol | D. | 2H2(g)+O2(g)=2H2O(l)△H=-517.6kJ/mol |
分析 热化学方程式中,反应物和生成物必须表明各物质的存在状态,放热反应的焓变为“-”,吸热反应时焓变为“+”,书写热化学方程式还必须遵循质量守恒定律,据此进行解答.
解答 解:A.碳的燃烧为放热反应,反应的热化学方程式为:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol,故A正确;
B.热化学方程式必须满足质量守恒,正确的热化学方程式为:2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ/mol,故B错误;
C.氢气的燃烧为放热反应,计量数表示物质的量,可以为分数,该反应的热化学方程式可以为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,故C正确;
D.氢气的燃烧为放热反应,焓变为负值,该反应的热化学方程式可以为:2H2(g)+O2(g)=2H2O(l)△H=-517.6kJ/mol,故D正确;
故选B.
点评 本题考查反应热与焓变,为高频考点,把握热化学方程式的书写、物质的量与热量的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1 mol•L-1硫酸中所含的氧原子数为4NA | |
| B. | 标准状况下,11.2LCCl4所含的原子数为2.5NA | |
| C. | 2.3gNa中所含的电子数为1.1NA | |
| D. | 常温常压下,14g由N2与CO组成对混合气体中所含对原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
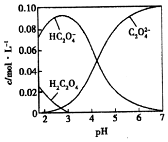 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )| A. | pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-) | |
| B. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| D. | pH=7.0的溶液中:c(Na+)=2(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的平均反应速率为0.15mol•L-1•min-1 | |
| B. | 恒温下达到平衡的标志是C和A的生成速率相等 | |
| C. | 降低平衡体系的温度,逆反应速率变小,正反应速率增大 | |
| D. | B的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
| 沸点/℃ | 178 | 205 | 249 | 80 |
| 熔点/℃ | 26 | -15 | 122 | 5.5 |
| 苯甲酸在水中的溶解度 | ||
| 17℃ | 25℃ | 100℃ |
| 0.21g | 0.34g | 5.9g |


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 将XZ2通入W单质与水反应后的溶液中,一定只生成碳酸钠、碳酸氢钠 | |
| C. | 由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键 | |
| D. | CaX2、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中氯元素被氧化 | |
| B. | NaCN既是氧化剂又是还原剂 | |
| C. | 生成0.lmol N2,转移1mol电子 | |
| D. | 氧化产物与还原产物的物质的域之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com