
只给出下列甲和乙中对应的物理量,不能求出物质的量的是( )
A.甲:物质中的粒子数;乙:阿伏加德罗常数
B.甲:标准状况下的气体摩尔体积;乙:标准状况下的气体体积
C.甲:固体的体积;乙:固体的密度
D.甲:溶液中溶质的物质的量浓度;乙:溶液体积
科目:高中化学 来源: 题型:
已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以缓慢结合的方式进行的,具有
高度特异性,其分子结构如下所示。
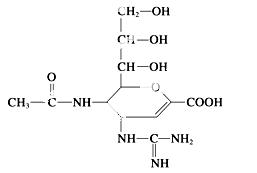
下列说法正确的是 ( )
A.该物质的分子式为C12H19N4O7
B.1 mol该物质与NaOH溶液反应,可以消耗4 mol NaOH
C.在一定条件下,该物质可以发生消去、加成、取代等反应
D.该物质能使溴水或酸性高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
有关①100mL 0.1mol/L NaHCO3 ②100mL 0.1mol/L Na2CO3两种溶液的叙述不正确的是( )
A.溶液中水电离出的H+个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO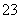 )>c(H2CO3)
)>c(H2CO3)
D.②溶液中:c(HCO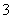 )>c(H2CO3)
)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
阿伏加德罗常数约为6.02×1023 mol-1,下列说法正确的是( )
A.2.3 g钠与足量丙三醇反应,转移电子数为0.3×6.02×1023
B.标准状况下,22.4 L乙醇的共价键数为8×6.02×1023
C.标准状况下,5.6 L甲醛所含的电子数为4×6.02×1023
D.100 mL 1 mol·L-1醋酸溶液中,H+的个数为0.1×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中,能发生银镜反应,滴入紫色石蕊试液不变色,加入少量氢氧化钠溶液,再加入酚酞试液变红色,共煮后红色变浅的是( )
A.乙酸甲酯 B.甲酸乙酯
C.硬脂酸 D.油酸甘油酯
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.1 mol Na2O2固体中含有的O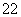 数为2NA
数为2NA
B.常温常压下,3.2 g CH4中含有的电子数为2NA
C.标准状况下,11.2 L CH3CH2OH中含有的分子数为0.5NA
D.100 mL 1 mol·L-1的CH3COOH溶液中含有的CH3COOH分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
若NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 mol Na2CO3·10H2O晶体中,阴离子总数大于0.1NA
B.常温常压下,18 mL水中所含氢离子数约为10-7NA
C.标准状况下,22.4 L氦气中含有的原子数约为NA
D.23 g组成为C2H6O的有机物,C—H键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式_______________________________________________________________。
(2)已知:甲醇脱水反应 2CH3OH(g)===CH3OCH3(g)+H2O(g) ΔH1=-23.9 kJ·mol-1
甲醇制烯烃反应 2CH3OH(g)===C2H4(g)+2H2O(g) ΔH2=-29.1 kJ·mol-1
乙醇异构化反应 C2H5OH(g)===CH3OCH3(g)
ΔH3=+50.7 kJ·mol-1
则乙烯气相直接水合反应C2H4(g)+H2O(g)===C2H5OH(g)的ΔH=________kJ·mol-1。与间接水合法相比,气相直接水合法的优点是__________________________。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n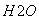 :n
:n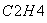 =1:1]
=1:1]
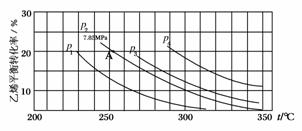
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强p1、p2、p3、p4的大小顺序为:________,理由是:______________________。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9 MPa,n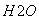 :n
:n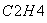 =0.6:1。乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有:________________、________________。
=0.6:1。乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有:________________、________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫是一种很活泼的元素,在适宜的条件下能形成-2、+6、+4、+2、+1价的化合物。
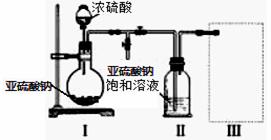 I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。带有强烈的SO2气味,水溶液生成NaHSO3呈酸性,久置空气中易氧化,故该产品不能久存。某研究小组采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。
I:焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。带有强烈的SO2气味,水溶液生成NaHSO3呈酸性,久置空气中易氧化,故该产品不能久存。某研究小组采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。
(1)装置I中的浓硫酸______ (能或不能)用稀硫酸代替,
原因是 。
(2)装置Ⅱ中有Na2S2O5晶体析出,要获得已析出的晶体,可采取的分离方法是_____________。
(3)装置Ⅲ用于处理尾气,请在虚线内画出尾气处理装置和药品。
(4)检验Na2S2O5晶体在空气中变质的实验方案是 。
II:而另一种硫的化合物Na2S2O3的溶液可以用于测定溶液中ClO2的含量,可进行以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
(1)准确量取10.00 mL ClO2溶液的玻璃仪器是 。
(2)确定滴定终点的现象为__________________________________。
(3)根据上述步骤计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)
(4)下列操作会导致测定结果偏高的是 。
A.未用标准浓度的Na2S2O3溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.滴定应在中性或弱酸性环境中进行,若溶液呈碱性
E.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com