
����Ŀ����֪��ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ���������������ԭ������ش��������⣺
��1�����淴ӦFeO(s)��CO(g)![]() Fe(s)��CO2(g)��������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
Fe(s)��CO2(g)��������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
T/K | 938 | 1 100 |
K | 0.68 | 0.40 |
���÷�Ӧ������̶����ܱ������н��У���һ�������´ﵽƽ��״̬���������¶ȣ���������ƽ����Է�������__�����뺤�������������ܶ�__(��������������С������������)��
��2��830�棬��ӦCO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)��ƽ�ⳣ��K=1����2L���ݷ�Ӧ���з���������Ӧ���ֱ����3molCO2��2molH2��1molCH3OH��4molH2O(g)����Ӧ��__������С�������������桱���ƶ�����
CH3OH(g)��H2O(g)��ƽ�ⳣ��K=1����2L���ݷ�Ӧ���з���������Ӧ���ֱ����3molCO2��2molH2��1molCH3OH��4molH2O(g)����Ӧ��__������С�������������桱���ƶ�����
��3��25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ | CH3COOH | NH3��H2O | H2CO3 | H2SO3 |
����ƽ�ⳣ�� | 1.7��10-5 | 1.7��10-5 | K1��4.3��10-7 K2��5.6��10-11 | K1��1.3��10-2 K2��6.3��10-8 |
��д��CH3COOH�ĵ��뷽��ʽ____�������ƽ�ⳣ������ʽK a=___��
�ڸ��ݱ��������жϣ�Ũ�Ⱦ�Ϊ0.01mol��L-1�������������ʵ���Һ�У�������ǿ����___(����)�������и���Һ�ֱ�ϡ��100����pH�仯��С����___(����)��
A��CH3COOH B��H2CO3 C��H2SO3
���𰸡���С ���� �� CH3COOH ![]() H++CH3COO-
H++CH3COO- 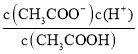 C B
C B
��������
(1)���ݱ������ݿ�֪�������¶ȣ�ƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ����ݴ˷������
(2)���ȼ���c(CO2)��c(H2)��c(CH3OH)��c(H2O)���ټ���Ũ���̣���K�ȽϺ��жϷ�Ӧ�ķ���
(3)��CH3COOHΪ���ᣬ�ݴ���д���뷽��ʽ�������ݵ��뷽��ʽ��д����ƽ�ⳣ������ʽ����KԽ������Խǿ������Խǿ��ϡ��100����pH�仯Խ�ݴ˷������
(1)�����¶ȣ�ƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ��������������С�����ʵ������䣬��������ƽ����Է���������С�����뺤������Ӧ������䣬�������������������ܶ����ʴ�Ϊ����С������
(2)c(CO2)=![]() =1.5mol/L��c(H2)=
=1.5mol/L��c(H2)=![]() =1mol/L��c(CH3OH)=
=1mol/L��c(CH3OH)=![]() =0.5mol/L ��c(H2O)=
=0.5mol/L ��c(H2O)=![]() =2mol/L����Ũ����=
=2mol/L����Ũ����=![]() =
=![]() ��K=1����Ӧ������У��ʴ�Ϊ������
��K=1����Ӧ������У��ʴ�Ϊ������
(3)��CH3COOHΪ���ᣬ���뷽��ʽΪCH3COOH ![]() H++CH3COO-������ƽ�ⳣ������ʽK a=
H++CH3COO-������ƽ�ⳣ������ʽK a=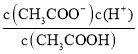 ���ʴ�Ϊ��CH3COOH
���ʴ�Ϊ��CH3COOH ![]() H++CH3COO-��
H++CH3COO-��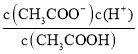 ��
��
��KԽ��ʾ����̶�Խ������Խǿ�����ݱ������ݿ�֪��H2SO3��K1������H2SO3������ǿ������Խǿ��ϡ��100����pH�仯Խ����pH�仯��С��������������H2CO3���ʴ�Ϊ��C��B��


 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д� �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��֪��Ӧ2HI(g)=H2(g)+I2(g)�ġ�H=+11kJ��mol-1��1molH2(g)��1molI2(g)�����л�ѧ������ʱ�ֱ���Ҫ����436kJ��151kJ����������1molHI(g)�����л�ѧ������ʱ�����յ�����Ϊ______________kJ��
(2)��֪ij�ܱ������д�������ƽ�⣺CO(g)+H2O(g)![]() CO2(g)+H2(g)��CO��ƽ�����ʵ���Ũ��c(CO)���¶�T�Ĺ�ϵ��ͼ��ʾ��
CO2(g)+H2(g)��CO��ƽ�����ʵ���Ũ��c(CO)���¶�T�Ĺ�ϵ��ͼ��ʾ��
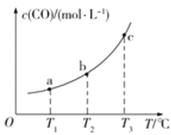
�ٸ÷�Ӧ��H_____________0(����������������)
����T1��T2ʱ��ƽ�ⳣ���ֱ�ΪK1��K2����K1_____________K2(��������������������=��)��
(3)�ں����ܱ������У�����������MoS2��O2����������Ӧ��2MoS2(s)+7O2(g)![]() 2MoO3(s)+4SO2(g)��H�����������ƽ��ת��������ʼѹǿ���¶ȵĹ�ϵ��ͼ��ʾ��
2MoO3(s)+4SO2(g)��H�����������ƽ��ת��������ʼѹǿ���¶ȵĹ�ϵ��ͼ��ʾ��
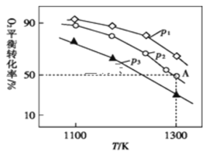
��p1��p2��p3�Ĵ�С��___________��
������ʼʱͨ��7.0molO2��p2Ϊ7.0kPa����A��ƽ�ⳣ��Kp=___________(������ƽ���ѹ��������ƽ��Ũ�ȼ��㣬��ѹ=��ѹ����������ʵ���������д������ʽ����)��
(4)�п�Ժ���ݻ�ѧ�����о�����Fe3(CO)12/ZSM-5��CO2����ϳɵ�̼ϩ����Ӧ�����ò��ﺬCH4��C3H6��C4H8�ȸ������Ӧ������ͼ��
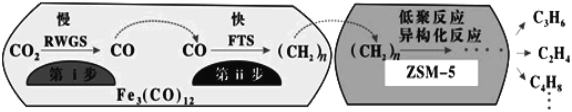
����������Na��K��Cu������(����Ҳ�������)�ɸı䷴Ӧ��ѡ���ԣ�������������ͬʱ�����Ӳ�ͬ������������ͬʱ�����CO2ת���ʺ���������ʵ������������
���� | CO2ת����(%) | �����������в����е�ռ��(%) | ||
C2H4 | C3H6 | ���� | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
������ߵ�λʱ������ϩ�IJ�������Fe3(CO)12/ZSM-5������_______����Ч����ã�������������ߵ�λʱ������ϩ�����ĸ���ԭ����:___________
������˵����ȷ����______��
a���������ķ�ӦΪ��CO2+H2![]() CO+H2O
CO+H2O
b����������Ӧ�Ļ�ܵ��ڵ�����
c������������Ҫ�ڵ;۷�Ӧ���칹����Ӧ����������
d��Fe3(CO)12/ZSM-5ʹCO2����ϳɵ�̼ϩ������H��С
e�����Ӳ�ͬ������Ӧ��ƽ�ⳣ��������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������[K3Fe(C2O4)33H2O]���Ʊ������ͻ�������������Ҫԭ�ϡ�ij��ѧС��̽���÷���м��������-2��SԪ�أ�Ϊԭ���Ʊ������������������ؾ��塣����������ͼ��
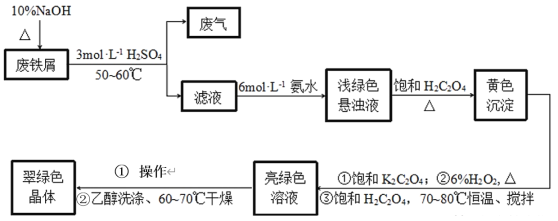
��֪����(NH4)2Fe(SO4)26H2OΪ����ɫ���壬FeC2O4��2H2OΪ������ˮ�Ļ�ɫ���壬K3Fe(C2O4)3��3H2OΪ������ˮ���������Ҵ��Ĵ���ɫ���塣
��25��ʱ��[Fe(C2O4)3]3-(aq)+SCN-(aq)![]() [Fe(SCN)]2+(aq)+3C2O
[Fe(SCN)]2+(aq)+3C2O![]() (aq) K=6.31��10-17��
(aq) K=6.31��10-17��
��[Fe(SCN)]2+(aq)ΪѪ��ɫ��
�ش��������⣺
��1��������������[K3Fe(C2O4)33H2O]�����Ļ��ϼ���_____��
��2������м�м���10%NaOH�����ȵ�Ŀ����__��
��3��Ϊ��ֹ��Ⱦ��������Ӧ������������������ѡ��__����������(��ѡ��)
A��H2O B��NaOH��Һ C������ D��CuSO4��Һ
��4��д��dz��ɫ����Һ�м��뱥��H2C2O4���ɻ�ɫ�����Ļ�ѧ����ʽ��__��
��5���Ʊ������м���6%H2O2��Ŀ����__���¶ȱ���70~80�������õĺ��ʼ��ȷ�ʽ��__��
��6����ô��̾���IJ�������___��
��7�����Ҵ�ϴ�Ӿ����ԭ����___��
��8��ijͬѧ���������ƾ����е�Fe��������ȡ������������Թ��У�������ˮʹ�����ܽ⣬�����Թ��е��뼸��0.1molL-1KSCN��Һ�����ж�����ʵ�鷽���Ƿ���в�˵�����ɣ�___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ȼ�ѧ����ʽ��˵����ȷ����
A. H2��ȼ����Ϊ285.8 kJ��mol1�����ʾH2ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��H2(g)+ ![]() O2
O2![]() H2O(g) ��H=285.8 kJ��mol1
H2O(g) ��H=285.8 kJ��mol1
B. �к���Ϊ57.3 kJ��mol1����NaOH����ᷴӦ���к��ȿ��Ա�ʾ���£�NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ��H=57.3 kJ��mol1
CH3COONa(aq)+H2O(l) ��H=57.3 kJ��mol1
C. ��֪��C(s�����ʯ)+O2(g)![]() CO2(g) ��H=395.4 kJ��mol1��C(s��ʯī)+O2(g)
CO2(g) ��H=395.4 kJ��mol1��C(s��ʯī)+O2(g)![]() CO2(g) ��H=393.5 kJ��mol1����C(s�����ʯ)
CO2(g) ��H=393.5 kJ��mol1����C(s�����ʯ)![]() C(s��ʯī)��H=1.9 kJ��mol1
C(s��ʯī)��H=1.9 kJ��mol1
D. ��֪1 mol CH4��ȫȼ������CO2��Һ̬ˮ�ų�890.4 kJ����������÷�Ӧ��ת��1 mol����ʱ�ų�������Ϊ222.6 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����___(�����)��
�ٽ�1 mol NaCl�ܽ���1 Lˮ�У��ɵ�1 mol��L��1NaCl����Һ
�ڽ�11.2 L HCl����ͨ��ˮ���0.5 L��Һ���õ�1 mol��L��1������
��1 L 10 mol��L��1��������9 Lˮ��ϣ��õ�1 mol��L��1������
�ܽ�0.4 g NaOH�ܽ�ˮ���γ�100 mL��Һ������ȡ��10 mL����ȡ��Һ���ʵ���Ũ��Ϊ0.1 mol��L��1(��������Һ����ı仯)
�ݽ�1 mol Na2O����ˮ���1 L��Һ���������ʵ����ʵ���Ũ��Ϊ1 mol��L��1(��������Һ����ı仯)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ͼ��ʾʵ��װ�ã�Ŀ����������ˮ��Ӧʵ�飬����֤���Ƶ��������ʣ�������ˮ��Ӧ�IJ�����ʲô��

��1���������ʵ�����ʱ����Ҫ��������________��
��2����ν��в�����__________��
��3��ʵ��������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
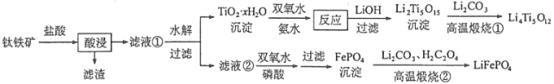
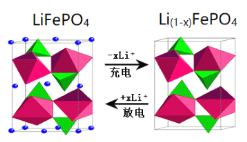
����Ŀ������6�±��ǵ���ʽ������Ƭ��أ����������˵綯������������̿�������˹������Ƭ��ز���������﮼�����������������[��Ҫ�ɷ�ΪFeTiO3(������������)������������MgO������]���Ʊ�LiFePO4��Li4Ti5O12������ӵ�صĵ缫���ϣ�����������ͼ��
�ش��������⣺
(1)�������������Ҫ��TiOCl42-��ʽ���ڣ�д����Ӧ��Ӧ�����ӷ���ʽ _______��
(2)TiO2xH2O������˫��ˮ����ˮ����Ӧ��ת����(NH4)2Ti5O15��Һʱ��TiԪ�صĽ������뷴Ӧ�¶ȵĹ�ϵ��ͼ��ʾ��
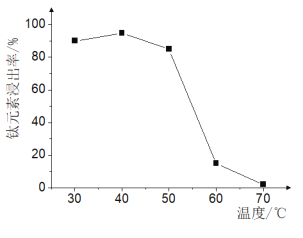
��Ӧ�¶ȹ���ʱ��TiԪ�ؽ����ʱ仯��ԭ���� ________��
(3)����Һ�����к��еĽ��������� _______������˫��ˮ������ʹFe3+ǡ�ó�����ȫ������Һ��c(Fe3+)=1.0��10-5 mol��L-1����ʱ��Һ�� c(PO43-)=________��(FePO4�� Ksp=1.3��10 -22)
(4)д�����������բ�������FePO4�Ʊ�LiFePO4�Ļ�ѧ����ʽ______��
(5)Li2Ti5O15��Ti�Ļ��ϼ�Ϊ+4�����й���������ĿΪ_____��
(6)��Ϊ��Ƭ����������ϵ���������ڳ䡢�ŵ�ʱ�ľֲ��Ŵ�ʾ��ͼ��ͼ���������缫��Ӧʽ��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������������Ƭ�ϵ�ʳ��ˮ������һ��ʱ�����Ƭ���������������Ƭ��ʴ�����з������ܻ�ѧ����ʽ��2Fe��2H2O��O2===2Fe(OH)2��Fe(OH)2��һ������������ΪFe(OH)3������һ����������ˮ������������ԭ����ͼ������˵����ȷ����(����)

A. ��Ƭ������ԭ��Ӧ������ʴ
B. ��Ƭ��ʴ����������Ӧ����������������
C. ��Ƭ��ʴ�и��������ĵ缫��Ӧ��2H2O��O2��4e��===4OH��
D. ��Ƭ�������̼��ʳ��ˮ�γ�����Сԭ����������˵绯ѧ��ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����H2��g��+![]() O2��g��= H2O��l�� ��H= ��285.8 kJ/mol
O2��g��= H2O��l�� ��H= ��285.8 kJ/mol
��H2��g��+![]() O2��g��= H2O��g�� ��H= ��241.8kJ/mol
O2��g��= H2O��g�� ��H= ��241.8kJ/mol
��C(s)+![]() O2 (g) = CO (g) ��H= ��110.5kJ/mol
O2 (g) = CO (g) ��H= ��110.5kJ/mol
��C(s)+ O2 (g) = CO2 (g) ��H= ��393.5kJ/mol
�ش��������⣺
������Ӧ�����ڷ��ȵ���_________��H2��ȼ����Ϊ________��C��ȼ����Ϊ_____��
��2�����͵���Ҫ�ɷ������飨C8H18����1 mol C8H18��l����O2��g����ȼ�գ�����CO2��g����H2O��l�����ų�5518 kJ��������д���˷�Ӧ���Ȼ�ѧ����ʽ___________
��3����������������Ӧ����1molˮ��������241.8kJ����1gˮ����ת����Һ̬ˮʱ����2.444kJ����д��������ȼ���ȵ��Ȼ�ѧ����ʽ________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com