
| A. | 硫酸、纯碱、氯化钙 | B. | 盐酸、烧碱、小苏打 | ||
| C. | 碳酸、乙醇、醋酸钠 | D. | 磷酸、熟石灰、过氧化钠 |
科目:高中化学 来源: 题型:选择题
 硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )
硼化钒(VB2)、空气电池是目前储电能力最高的电池,电池示意图如图.该电池的反应产物分别是V2O5和B的最高价氧化物.下列说法正确的是( )| A. | 图中选择性透过膜应只允许阴离子通过 | |
| B. | 电池工作过程中a电极附近溶液pH减小 | |
| C. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| D. | 如果负载为氯碱工业装置,外电路中转移0.1mol电子,则阴极生成气体1120mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度不变,减小压强,A的转化率增大 | |
| B. | 升高温度,减小体积,有利于平衡向正反应方向移动 | |
| C. | 增大A的浓度,平衡正向移动,A的转化率增大 | |
| D. | 降低温度,正反应速率增大,逆反应速率减小,平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中滴入偏铝酸钠溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| B. | 饱和碳酸钠溶液中通入过量二氧化碳气体:CO32-+CO2+H2O═2HCO3- | |
| C. | NaHSO3溶液与FeCl3溶液混合溶液颜色变浅:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+ | |
| D. | 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期元素X、Y、Z、Q、R、W的原子序数依次增大.X基态原子的2p轨道为半充满状态;Y基态原子的L层有2个未成对电子;Z基态原子的最外层电子排布为3s23p2;Q、R、W都属于金属元素,Q、W基态原子核外均没有未成对电子,R基态原子的d轨道上有3个空轨道.
前四周期元素X、Y、Z、Q、R、W的原子序数依次增大.X基态原子的2p轨道为半充满状态;Y基态原子的L层有2个未成对电子;Z基态原子的最外层电子排布为3s23p2;Q、R、W都属于金属元素,Q、W基态原子核外均没有未成对电子,R基态原子的d轨道上有3个空轨道.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
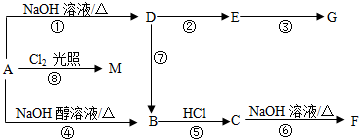
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有一无色透明溶液,可能含Al3+、Fe3+、Cu2+、Mg2+、K+、OH-、CO32-、Cl-离子中的若干种.现做如下实验:
有一无色透明溶液,可能含Al3+、Fe3+、Cu2+、Mg2+、K+、OH-、CO32-、Cl-离子中的若干种.现做如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要配置480mL该溶液,应选用500mL容量瓶 | |
| B. | 固体NaOH须放到烧杯中称量 | |
| C. | 把称好的固体加水溶解后马上转移到容量瓶中 | |
| D. | 定容时俯视刻度线,所配NaOH溶液浓度会偏大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com