
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)在700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2 > t1):
反应时间/min | 0 | t1 | t2 |
n(CO)/mol | 1.20 | 0.80 | 0.80 |
①反应在t1min内的平均速率:v(H2)=____mol·L-1·min-1。
②t2时刻,该反应的正反应速率___逆反应速率(填“大于”、“小于”或“等于”)。
(2)氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。
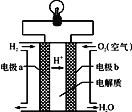
①该电池供电时,____能转化为____能。
②写出该电池供电时的总反应方程式________。
③电极b上发生______反应(“氧化”或“还原”)。
④在外电路中,电子流动的方向为________。
(3)镁铝合金(Mg17Al10)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al10+17H2=17MgH2+10Al。得到的混合物Y(17MgH2+10Al)在一定条件下可释放出氢气。
①镁铝合金的熔点比金属镁的熔点______。(填“高”或“低”)
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al10完全吸氢后得到的混合物Y与足量上述盐酸完全反应,释放出H2的物质的量为______。
【答案】0.2/t1 等于 化学 电 2H2+O2=2H2O 还原 由a到b 低 49
【解析】
(1)①根据表格数据首先计算v(CO),再根据速率之比=化学计量数之比计算v(H2);②反应在t2时刻为平衡状态;
(2)氢氧燃料电池中,氢气易失电子发生氧化反应,所以通入氢气的电极a是负极,氧气易得电子发生还原反应,所以通入氧气的电极b是正极,电流由正极电极b通过导线流向负极电极a,据此分析解答;
(3)①合金的熔点比成分金属的熔点低;②释放出的H2 包括Mg17Al12吸收的氢,还包括镁、铝和盐酸反应生成的氢气。
(1)①根据表格数据,反应在t1min时达到平衡状态,v(CO)= =
=![]() mol·L-1·min-1,则v(H2)=v(CO)=
mol·L-1·min-1,则v(H2)=v(CO)=![]() mol·L-1·min-1,故答案为:
mol·L-1·min-1,故答案为:![]() ;
;
②根据表格数据t2时刻为平衡状态,反应的正反应速率等于逆反应速率,故答案为:等于;
(2)①燃料电池中,将化学能转化为电能,故答案为:化学;电;
②氢氧燃料电池的总反应式为2H2+O2═2H2O,故答案为:2H2+O2═2H2O;
③氢氧燃料电池中通入氧气的电极b是正极,发生还原反应,故答案为:还原;
④在原电池中电子从负极沿导线流向正极,a是负极、b是正极,则电子由电极a通过导线流向电极b,故答案为:由a到b;
(3)①合金的熔点比成分金属的熔点低,因此镁铝合金的熔点比金属镁的熔点低,故答案为:低;
②根据反应的方程式,1molMg17Al10完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,生成氢气的物质的量分别为17mol、10×![]() =15mol,则生成氢气一共(17+17+15)mol=49mol,故答案为:49mol。
=15mol,则生成氢气一共(17+17+15)mol=49mol,故答案为:49mol。


科目:高中化学 来源: 题型:
【题目】下图为周期表中短周期的一部分,W、X、Y、Z四种元素最外层电子数之和为24。下列说法正确的是
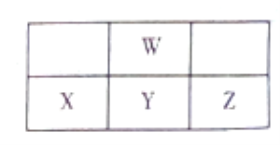
A. X、Y、Z的含氧酸的酸性依次增强
B. W元素形成的单核阴离子还原性强于X
C. Y、W形成的化合物一定能使酸性KMnO4溶液褪色
D. W与氢元素形成的化合物中可能含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. NH4+中质子数和电子数相等 B. 乙醇比乙二醇的沸点低
C. 乙炔与苯的实验式均为 CH D. 过氧化钠与过氧化氢中均含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况可能引起大气污染的是( )
①煤的燃烧;②工业废气任意排放;③燃放鞭炮;④飞机、汽车尾气的排放
A.只有①②B.只有②④
C.只有①②④D.只有①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: ________________________________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有__________________________________________。
②如何证明晶体已洗净?_________________________________________。
(4)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4 +8H2O设计如下原电池,盐桥中装有饱和KCl溶液。下列说法正确的是

A. b电极上发生还原反应
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为:MnO4-+8H++5e- = Mn2++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在固定容积的密闭容器中,能表示反应X(气)+2Y(气)![]() 2Z(气)一定达到化学平衡状态的是( )
2Z(气)一定达到化学平衡状态的是( )
A.容器内压强不随时间改变
B. c(X).c(Y)2=c(Z)2
C.正反应生成Z的速率与逆反应生成X的速率相等
D.容器内混合气体的密度不随时间改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知自然界氧的同位素有16O , 17O ,18O,若氢的同位素有H、D、T,从水分子的原子组成来看,自然界的水一共有几种
A.18种B.6种C.9种D.12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属桥墩腐蚀及防护是跨海建桥的重要课题。下列有关判断中正确的是


A. 用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀
B. ②中桥墩与外加电源正极连接能确保桥墩不被腐蚀
C. ③中采用了牺牲阳极的阴极保护法保护桥墩
D. ①②③中海水均是实现化学能与电能相互转化的电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com