
| A. | 硫酸中放出氢气量最多 | B. | 反应速率H2SO4>HCl>CH3COOH | ||
| C. | 放出氢气量:HCl>CH3COOH | D. | 放出氢气量:HCl=CH3COOH |
分析 A.放出的氢气的量取决于能够提供氢离子的总物质的量;
B.反应速率与溶液中氢离子浓度大小有关;
C.盐酸和醋酸都是一元酸,二者等浓度、等体积时能够提供的氢离子的总物质的量相等,则生成氢气的量相等;
D.等浓度、等体积的盐酸和醋酸与足量锌反应生成氢气的量相等.
解答 解:A.在同体积0.1mol•L-1的H2SO4、HCl、CH3COOH溶液中,硫酸为二元强酸,其提供的氢离子的物质的量最大,则生成氢气的量最大,故A正确;
B.反应速率受氢离子浓度大小影响,0.1mol•L-1的H2SO4、HCl、CH3COOH溶液中氢离子浓度最大的为硫酸,其次为盐酸,则反应速率大小为:H2SO4>HCl>CH3COOH,故B正确;
C.同体积0.1mol•L-1的HCl、CH3COOH溶液中能够提供的氢离子的总物质的量相等,则与足量锌反应时生成氢气的量相等,故C错误;
D.同体积0.1mol•L-1的HCl、CH3COOH溶液中能够提供的氢离子的总物质的量相等,则与足量锌反应时生成氢气的量HCl=CH3COOH,故D正确;
故选C.
点评 本题考查了反应速率的影响因素、弱电解质的电离等知识,题目难度中等,明确影响反应速率的因素为解答关键,注意掌握弱电解质的电离平衡及其影响,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 化学反应的平衡常数越大,反应进行的速率越快 | |
| B. | 加热、蒸干NaAlO2溶液和AlCl3溶液,并灼烧都得到Al2O3 | |
| C. | CH3COOH 溶液加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值不变 | |
| D. | 0.1mol•L-1CH3COONa溶液中加入少量固体NaOH,碱性增强,平衡向水解方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
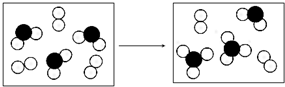
 .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.00mol NaCl中含有6.02×1023个NaCl分子 | |
| B. | 欲配制1.00 L 1.00mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| C. | 1.00mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023 | |
| D. | 电解58.5g 熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0g金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸、碱、盐都是电解质 | |
| B. | 蔗糖、酒精是非电解质 | |
| C. | 盐酸是强电解质 | |
| D. | NH3的水溶液能导电,但NH3不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
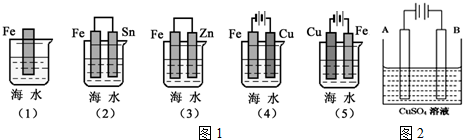
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com