
| A. | Mg2+、NH${\;}_{4}^{+}$、OH-、SO${\;}_{4}^{2-}$ | B. | Na+、H+、Cl-、HCO${\;}_{3}^{-}$ | ||
| C. | Na+、K+、AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$ | D. | H++、K+、MnO${\;}_{4}^{-}$、SO${\;}_{3}^{2-}$ |
分析 A.铵根离子、镁离子都与氢氧根离子反应;
B.氢离子与碳酸氢根离子发生反应;
C.四种离子之间不反应,能够共存;
D.酸性条件下高锰酸根离子能够氧化亚硫酸根离子.
解答 解:A.NH4+、Mg2+都与OH-反应,在溶液中不能大量共存,故A错误;
B.H+、HCO3-之间反应生成二氧化碳气体和水,在溶液中不能大量共存,故B错误;
C.Na+、K+、AlO2-、CO32-之间不发生反应,在溶液中能够大量共存,故C正确;
D.MnO4-、SO32-在存在H+条件下能够发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 所有醛都含有醛基和烃基 | |
| B. | 羟基上氢的活性:羧酸>水>苯酚>醇 | |
| C. | 丁酸与甲酸乙酯互为同分异构体 | |
| D. | 乙二酸是最简单的二元羧酸,具有一定的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 1.00 | 21.00 |
| 3 | 25.00 | 1.20 | 21.21 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
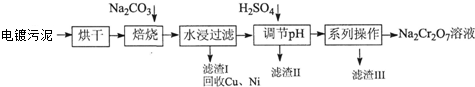
| 20℃ | 60℃ | 100℃ | |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7[来源:] | 183 | 269 | 415 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子直径在10-9~l0-7m之间 | B. | 是一种纯净物 | ||
| C. | 具有丁达尔效应 | D. | 具有净水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
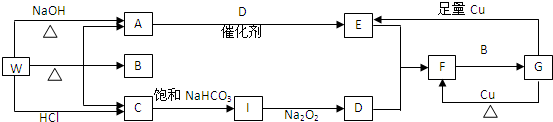
 如图转化关系图(反应条件均略去)中A、C、E、G均为单质,其中A、C、G为金属;E为气体;B为无色液体;A、G在冷的浓硫酸溶液中均发生钝化;F、I溶液的焰色均为黄色.
如图转化关系图(反应条件均略去)中A、C、E、G均为单质,其中A、C、G为金属;E为气体;B为无色液体;A、G在冷的浓硫酸溶液中均发生钝化;F、I溶液的焰色均为黄色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>b | B. | 离子的还原性:C2-<D- | ||
| C. | 氢化物的稳定性:H2C>HD | D. | 离子半径:B+>A3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com