
 C��g��+D��g�������ﵽƽ�⡣C�����������ʱ��仯��ͼ��������b��ʾ����Ӧ�����е������仯��ͼ����ʾ������˵������ȷ����
C��g��+D��g�������ﵽƽ�⡣C�����������ʱ��仯��ͼ��������b��ʾ����Ӧ�����е������仯��ͼ����ʾ������˵������ȷ����
 ��E
��E ����С
����С ��s
��s
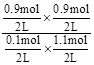 =7.36����ͼII��֪���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�ⳣ����С��B��ȷ������Ӧǰ�������������䣬������С���������ֻ�ӿ췴Ӧ���ʲ��ı�ƽ�⣬C��ȷ��4sʱAΪ0.1mol����v(A)=
=7.36����ͼII��֪���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�ⳣ����С��B��ȷ������Ӧǰ�������������䣬������С���������ֻ�ӿ췴Ӧ���ʲ��ı�ƽ�⣬C��ȷ��4sʱAΪ0.1mol����v(A)=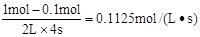 ��D����ѡD��
��D����ѡD��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢� | B���� | C���� | D���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
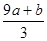 mol
mol�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A����֪2SO2(g)+O2 2SO3(g) Ϊ���ȷ�Ӧ����SO2������һ������SO3������ 2SO3(g) Ϊ���ȷ�Ӧ����SO2������һ������SO3������ |
| B����֪C(ʯī,s) ===C�����ʯ,s�� ��H��0������ʯ��ʯī�ȶ� |
| C��NaOH(aq)��HCl(aq)===NaCl(aq)��H2O(l)����H����57.4 kJ/mol����20 g NaOH����Һ������ϡ������ȫ��Ӧ���ų�������Ϊ28.7 kJ |
| D����֪2C(s) +2O2 (g) ===2CO2(g) ��H1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢ڢޢ� | B���ڢݢߢ� | C���ڢۢߢ� | D���ۢܢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����lmol����ת��ɺ���ʱ�ų�17kJ���� |
| B����4g����ת��ɰ���ʱ����17kJ���� |
| C������Ӧ��һ�����ȷ�Ӧ |
| D���������ȶ��ԱȺ��״� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����H1����H2����H3 | B����H1����H2����H3 |
| C����H1<��H2����H3 | D����H1����H2����H3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������������������ǹ���ֱ���ȫȼ�գ����߷ų��������� |
| B��������ȼ����Ϊ285.8 kJ��mol��1��������ȼ�յ��Ȼ�ѧ����ʽΪ2H2(g)��O2(g)��2H2O(l)����H��+571.6 kJ��mol��1 |
| C��Ba(OH)2��8H2O(s)��2NH4Cl(s)��BaCl2(s)��2NH3(g)��10H2O(l)����H��0 |
| D����֪�к���Ϊ57.3 kJ��mol��1��������0.5 mol H2SO4����Һ�뺬1 mol NaOH����Һ��ϣ��ų����������ܴ���57.3 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����������������ĩ��Ӧ | B���Ҵ�ȼ�� |
| C��̼������ȷֽ� | D���ⵥ������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com