
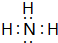 ,氨气的水溶液呈碱性,
,氨气的水溶液呈碱性,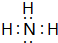 ;碱;
;碱;

科目:高中化学 来源: 题型:
 诺贝尔生理学和医学奖的最大一次失误是1948年授予了瑞士化学家米勒,由于米勒发明了剧毒有机氯杀虫剂DDT而获得当年诺贝尔奖.DDT的结构简式如图.由与DDT是难降解化合物,毒性残留时间长,世界各国现已明令禁止生产和使用.下列关于DDT的说法正确的是( )
诺贝尔生理学和医学奖的最大一次失误是1948年授予了瑞士化学家米勒,由于米勒发明了剧毒有机氯杀虫剂DDT而获得当年诺贝尔奖.DDT的结构简式如图.由与DDT是难降解化合物,毒性残留时间长,世界各国现已明令禁止生产和使用.下列关于DDT的说法正确的是( )| A、DDT分子中两苯环不可能共平面 |
| B、DDT属于芳香烃 |
| C、DDT分子可以发生消去反应 |
| D、DDT难以降解的原因是不能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
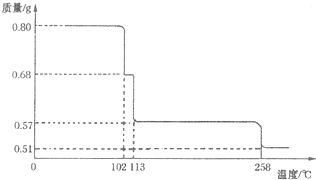 铜是一种与人类关系非常密切的有色金属.常温下,Cu2+在溶液中稳定,Cu+在酸性条件下易发生歧化反应:2Cu=Cu2++Cu;大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH 等.
铜是一种与人类关系非常密切的有色金属.常温下,Cu2+在溶液中稳定,Cu+在酸性条件下易发生歧化反应:2Cu=Cu2++Cu;大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH 等.查看答案和解析>>
科目:高中化学 来源: 题型:
 在Ni、NiO、Ni3C、γ-Al2O3组成的催化剂表面,可实现H2O、CO2及CH4合成乙醇.
在Ni、NiO、Ni3C、γ-Al2O3组成的催化剂表面,可实现H2O、CO2及CH4合成乙醇.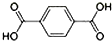 )、4,4’-联吡啶[
)、4,4’-联吡啶[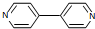 (可简化为
(可简化为 )]等与Ni2+能形成多核配合物.配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如下图:
)]等与Ni2+能形成多核配合物.配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如下图: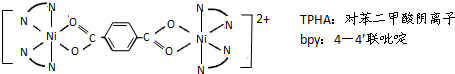
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com