
 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol•L-1的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:分析 由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O.当V(NaOH溶液)=160mL时,沉淀量最大,此时生成Mg(OH)2和Al(OH)3沉淀,沉淀质量为19.4g,溶液中溶质为NaCl,根据钠元素守恒可知此时n(NaCl)等于160mL氢氧化钠溶液中含有的n(NaOH);从160mL到180mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当V(NaOH溶液)=180mL时,沉淀不再减少,此时全部为Mg(OH)2,其质量为11.6g,n(Mg(OH)2)=$\frac{11.6g}{58g/mol}$=0.2mol,则沉淀量最大是Mg(OH)2为11.6g,Al(OH)3为19.4g-11.6g=7.8g,n(Al(OH)3)=$\frac{7.8g}{78g/mol}$=0.1mol,据此进行解答.
解答 解:由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O.当V(NaOH溶液)=160mL时,沉淀量最大,此时生成Mg(OH)2和Al(OH)3沉淀,沉淀质量为19.4g,溶液中溶质为NaCl,根据钠元素守恒可知此时n(NaCl)等于160mL氢氧化钠溶液中含有的n(NaOH);从160mL到180mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当V(NaOH溶液)=180mL时,沉淀不再减少,此时全部为Mg(OH)2,其质量为11.6g,n(Mg(OH)2)=$\frac{11.6g}{58g/mol}$=0.2mol,则沉淀量最大是Mg(OH)2为11.6g,Al(OH)3为19.4g-11.6g=7.8g,n(Al(OH)3)=$\frac{7.8g}{78g/mol}$=0.1mol;由于从160mL到180mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,所以该阶段消耗n(NaOH)=n[Al(OH)3]=0.1mol,氢氧化钠的浓度为$\frac{0.1mol}{0.18L-0.16L}$=5mol/L,
(1)将固体混合物投入稀盐酸中,所发生的氧化还原反应的离子方程式有:Mg与HCl反应、Al与HCl反应,反应的离子方程式分别为2Al+6H+=2Al3++3H2↑,Mg+2H+=Mg2++H2↑,
故答案为:2Al+6H+=2Al3++3H2↑、Mg+2H+=Mg2++H2↑;
(2)由图象可知,从160mL到180mL,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(3)混合物中含有0.2molMg、0.1molAl,根据电子守恒可知生成氢气的物质的量为:$\frac{0.2mol×2+0.1mol×3}{2}$=0.35mol,标准状况下0.35mol氢气的体积为:22.4L/mol×0.35mol=7.84L,
故答案为:7.84L;
(4)混合物中含有0.2molMg、0.1molAl,则混合物的质量为:24g/mol×0.2mol+0.1mol×27g/mol=7.5g,
故答案为:7.5g;
(5)加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,根据氯元素守恒n(HCl)=0.8mol,故盐酸的物质的量浓度为$\frac{0.8mol}{0.1L}$=8mol/L,
答:所用盐酸的物质的量浓度为8mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,明确图象曲线对应的反应原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 医学上可用碳酸钡代替硫酸钡用作“钡餐” | |
| B. | 生理盐水用于医疗输液是因为它属于强电解质 | |
| C. | 医学上用液氮作制冷剂是因为液氮的沸点很低 | |
| D. | 水中的钢闸门连接电源负极,利用了牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和乙烯都能使溴水褪色,且反应原理相同 | |
| B. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 分子式为C10H14苯环上只有一个取代基的芳香烃,其可能的结构有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g金属铝由原子变为离子时失去的电子数为NA | |
| B. | 在通常条件下,1mol氩气含有的原子数为2NA | |
| C. | 在标准状况下,2.24 L氨气所含的电子总数约为NA | |
| D. | 含有NA个原子的镁在足量的二氧化碳气体中充分燃烧生成固体的质量为40g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
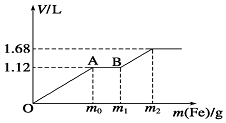 向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )
向100mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一阶段只对应一个反应.则下列说法正确的是( )| A. | 产生的气体中H2的物质的量为0.05mol | |
| B. | AB段发生反应的离子方程式为:Fe3++Fe=2Fe2+ | |
| C. | 所用混合溶液中c(H2SO4)=1.0 mol•L-1 | |
| D. | 反应后溶液中Fe2+的物质的量为0.025 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )
在Fe2(SO4)3和CuSO4的混合液中逐渐加入铁粉,溶液中Fe2+的物质的量浓度和加入铁粉的物质的量之间关系如图所示.若不考虑溶液体积变化,下列说法错误的是( )| A. | 溶液体积为2L | B. | n(SO42-)=4mol | ||
| C. | c【Fe2(SO4)3】:c【CuSO4】=1:1 | D. | 氧化性:Fe3+>Cu2+>Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 颜色和状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
| 银白色固体 | 较软 | 2.70g•cm-3 | 660.4℃ | 良好 | 良好 | 良好 |
| 一种猜想 | 验证方法 | 现象 | 结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com