
分析 (1)氯气在碱性溶液中自身发生氧化还原反应,生成氯化物和次氯酸盐,以此书写化学方程式;
(2)在反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O中,Mn元素的化合价降低,Cl元素的化合价升高,可从化合价变化的角度计算转移的电子的物质的量;
(3)将Cl2通入到湿润的有色布条中的现象中有色布条褪色.
解答 解:(1)氯气在碱性溶液中自身发生氧化还原反应,与石灰乳反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,故答案为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;
(2)在反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O中,Mn元素的化合价降低,Cl元素的化合价升高,方程式转移电子数为2mol,则Cl2为氧化产物,
MnO2为氧化剂,HCl为还原剂,但HCl并没有全部被氧化,根据化合价变化可知,氧化剂与还原剂的物质的量之比为1:2,
n(Cl2)=$\frac{0.672L}{22.4L/mol}$=0.03mol,故答案为:2; 1:2;0.03;
(3)将Cl2通入到湿润的有色布条中的现象中有色布条褪色,故答案为:有色布条褪色.
点评 本题考查氧化还原反应以及氯气的性质,题目难度不大,注意从化合价变化的角度分析氧化还原反应并进行相关的计算.


科目:高中化学 来源: 题型:选择题
| A. | 将水加热到100℃,使pH=6 | B. | 向水中加入Al2(SO4)3固体 | ||
| C. | 向水中加入Na2CO3溶液 | D. | 向水中加入NaHSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅单质溶于入氢氧化钠溶液中:Si+2OH-+H2O═SiO3-+2H2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 在碳酸氢镁溶液中加入过量氢氧化钠溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| D. | 向NaAlO2溶液中加入过量稀盐酸:AlO2-+4H+═Al3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol
(1)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol| T/°C | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
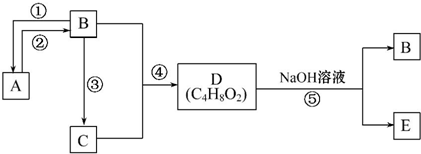
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
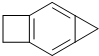 有机化合物的结构简式可进一步简化,如:
有机化合物的结构简式可进一步简化,如: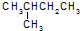 可简化为
可简化为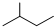 ,如图是一种形状酷似发射航天器的火箭的有机物分子(Rocketene),有关Rocketene的说法正确的是( )
,如图是一种形状酷似发射航天器的火箭的有机物分子(Rocketene),有关Rocketene的说法正确的是( )| A. | 该有机物属于烃的衍生物 | |
| B. | 该有机物属于苯的同系物 | |
| C. | Rocketene分子式为C9H8 | |
| D. | Rocketene与液溴用铁作催化剂反应生成的一溴代物有四种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com