
| A. | $\frac{22.4b}{a}$g•cm-3 | B. | $\frac{22400+17ab}{17000a}$g•cm-3 | ||
| C. | $\frac{22400+17ab}{a}$ g•cm-3 | D. | $\frac{22400b+17ab}{1000a}$g•cm-3 |
分析 根据n=$\frac{V}{{V}_{m}}$计算出标况下aL氨气的物质的量,再根据m=nM计算出氨气的质量,计算氨水的质量,根据V=$\frac{n}{c}$计算氨水体积,再根据ρ=$\frac{m}{V}$计算出该氨水的密度.
解答 解:标况下aL氨气的物质的量为:$\frac{aL}{22.4L/mol}$=$\frac{a}{22.4}$mol,氨气的质量为:17g/mol×$\frac{a}{22.4}$mol=$\frac{17a}{22.4}$g,
该氨水的质量为:1000g+$\frac{17a}{22.4}$g,该溶液的体积为:V=$\frac{\frac{a}{22.4}mol}{bmol/L}$=$\frac{a}{22.4b}$L,则溶液密度为$\frac{1000g+\frac{17a}{22.4}g}{\frac{a}{22.4b}×1000c{m}^{3}}$=$\frac{22400b+17ab}{1000a}$g/cm3,
故选D.
点评 本题考查了有关物质的量浓度、溶液密度相关的计算,题目难度中等,关键是溶液的体积,注意不能以水和氨气的体积作为溶液体积.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 2~4 s内的平均反应速率为0.2 mol•L-1•s-1 | |
| B. | 前4 s内的平均反应速率为0.3 mol•L-1•s-1 | |
| C. | 前2 s内的平均反应速率为0.4 mol•L-1•s-1 | |
| D. | 2 s末的反应速率为0.4 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
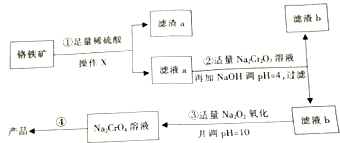 以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.
以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.| 阳离子 | Fe3+ | Fe2+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | |
| 沉淀完全的pH | 3.7 | 9.6 | 9(>9)溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
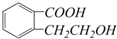 ,其分子式是C9H10O3,含氧官能团的名称是:羧基、醇羟基.
,其分子式是C9H10O3,含氧官能团的名称是:羧基、醇羟基.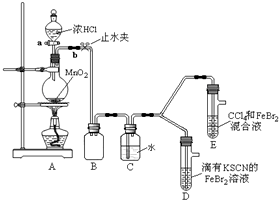
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化,持续通入一段时间后,CCl4层变为棕色 | ⑨单质、Br2、Fe3+的氧化性由强到弱的顺序是: ⑨单质(或Cl2)>Br2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
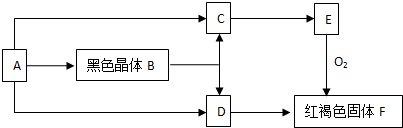
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.9 mol H2O | B. | 0.3 mol H2SO4 | C. | 0.2 mol NH3 | D. | 0.4 mol CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 营养平衡、科学使用食品添加剂有助于健康和提高免疫力.
营养平衡、科学使用食品添加剂有助于健康和提高免疫力.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com