
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 |
| I.向编号为①②③的3支试管中,分别加入1mL 20%的蔗糖溶液,向试管②和③中加入0.5mL稀硫酸,并将这3支试管同时水浴加热约5min | 均无明显现象 |
| II.取试管①和②,加入新制氢氧化铜悬浊液,加热至沸腾 | 均无明显现象 |
| III.取试管③,先加入NaOH溶液调溶液pH至碱性,再加入新制氢氧化铜悬浊液,加热至沸腾 | |
| 结论:证明蔗糖在稀硫酸作用下发生了水解反应 | |
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058

a.冰醋酸14.3mL(约0.25mol),b.95%乙醇23mL(约0.37mol),c.浓H2SO4,d.饱和 Na2CO3溶液,e.饱和CaCl2溶液(CaCl2易跟乙醇生成CaCl2·6C2H5OH)。
实验过程主要是将各装置连接好并检查气密性后,进行以下各步骤:
①在蒸馏烧瓶里注入少量乙醇和所需全部浓 H2SO4并混合均匀。在分液漏斗里加入剩下的乙醇和全部冰醋酸并混合均匀。
②用油浴加热,温度保持在130℃~140℃。
③将分液漏斗内液体缓缓滴入蒸馏烧瓶。调节滴入液体速率,使之与馏出酯的滴液速率大致相同,直到加料完毕。
④温度保持一段时间,至没有液体馏出时,停止加热。
⑤取下锥形瓶B,将饱和Na2CO3溶液分批分次加到馏出液里,边加边摇荡至没有气泡产生时为止。
⑥将B中液体在另一分液漏斗中分液,弃去水层。
⑦在分液漏斗油层中加入饱和CaCl2溶液,摇荡后静置,分层分液,弃去水层。油层为粗制乙酸乙酯。
试回答:
(1)配料中的乙醇和乙酸未按物质的量比1∶1配制的理由是________。
(2)浓H2SO4的作用是________。
(3)操作③使加料与馏出液速率大致相等的理由是________。
(4)用饱和Na2CO3溶液洗涤酯的目的是________,用饱和CaCl2溶液洗涤酯的目的是________。
(5)如果同时用Na2CO3与CaCl2两种饱和溶液冼涤酯时,会出现的情况是________。
(6)在粗酯中还杂有的主要有机物是________,产生它的原因是________。
(7)实验时B瓶支管有长导管通向室外的理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:058
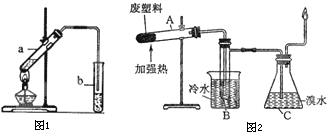
实验室制取乙酸乙酯的装置如图。实验使用的药品如下(烧杯夹持装置、温度计已略去):

a.冰醋酸14.3mL(约0.25mol),b.95%乙醇23mL(约0.37mol),c.浓H2SO4,d.饱和 Na2CO3溶液,e.饱和CaCl2溶液(CaCl2易跟乙醇生成CaCl2·6C2H5OH)。
实验过程主要是将各装置连接好并检查气密性后,进行以下各步骤:
①在蒸馏烧瓶里注入少量乙醇和所需全部浓 H2SO4并混合均匀。在分液漏斗里加入剩下的乙醇和全部冰醋酸并混合均匀。
②用油浴加热,温度保持在130℃~140℃。
③将分液漏斗内液体缓缓滴入蒸馏烧瓶。调节滴入液体速率,使之与馏出酯的滴液速率大致相同,直到加料完毕。
④温度保持一段时间,至没有液体馏出时,停止加热。
⑤取下锥形瓶B,将饱和Na2CO3溶液分批分次加到馏出液里,边加边摇荡至没有气泡产生时为止。
⑥将B中液体在另一分液漏斗中分液,弃去水层。
⑦在分液漏斗油层中加入饱和CaCl2溶液,摇荡后静置,分层分液,弃去水层。油层为粗制乙酸乙酯。
试回答:
(1)配料中的乙醇和乙酸未按物质的量比1∶1配制的理由是________。
(2)浓H2SO4的作用是________。
(3)操作③使加料与馏出液速率大致相等的理由是________。
(4)用饱和Na2CO3溶液洗涤酯的目的是________,用饱和CaCl2溶液洗涤酯的目的是________。
(5)如果同时用Na2CO3与CaCl2两种饱和溶液冼涤酯时,会出现的情况是________。
(6)在粗酯中还杂有的主要有机物是________,产生它的原因是________。
(7)实验时B瓶支管有长导管通向室外的理由是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com