
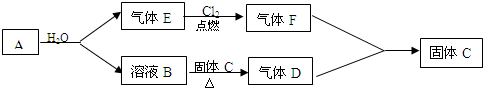

分析 A是一种金属,该金属能和水反应生成溶液B和气体E,B溶液能使酚酞试液变红,说明B是碱,焰色反应呈黄色,说明含有钠元素,所以B是NaOH,根据元素守恒知A是Na,E是H2;氢气在氯气中燃烧生成HCl,则F是HCl,氢氧化钠溶液和C反应生成D,D、F相遇会产生白烟,氯化氢和氨气反应生成白烟氯化铵,则D是NH3,C是NH4Cl,结合物质的性质分析解答.
解答 解:A是一种金属,该金属能和水反应生成溶液B和气体E,B溶液能使酚酞试液变红,说明B是碱,焰色反应呈黄色,说明含有钠元素,所以B是NaOH,根据元素守恒知A是Na,E是H2;氢气在氯气中燃烧生成HCl,则F是HCl,氢氧化钠溶液和C反应生成D,D、F相遇会产生白烟,氯化氢和氨气反应生成白烟氯化铵,则D是NH3,C是NH4Cl,
(1)D是NH3,D的电子式为: ,
,
故答案为: ;
;
(2)F是HCl,HCl极易溶于水生成盐酸,所以氯化氢在空气中遇水蒸气生成盐酸小液滴而产生白雾,
故答案为:盐酸小液滴;
(3)A→B反应的化学方程式为2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;
(4)B→D反应的化学方程式为:NaOH+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O,
故答案为:NaOH+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O.
点评 本题考查了无机物的推断,根据氨气和浓盐酸反应特征、钠焰色反应特征来分析解答即可,明确实验室制取氨气的方法,及氨气的检验方法,难度不大,注意烟和雾的区别.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.| n(SO32-):,n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
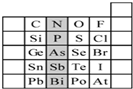 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.请用元素符号或化学式填空:
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.请用元素符号或化学式填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com