
| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
分析 将0.2mol/LCH3COOK与0.1mol/L盐酸等体积混合后,溶液中溶质为等物质的量浓度的CH3COOH、CH3COOK、KCl,CH3COOH电离程度大于CH3COO-水解程度导致混合溶液呈酸性,结合物料守恒判断.
解答 解:将0.2mol/LCH3COOK与0.1mol/L盐酸等体积混合后,溶液中溶质为等物质的量浓度的CH3COOH、CH3COOK、KCl,CH3COOH电离程度大于CH3COO-水解程度导致混合溶液呈酸性,
但CH3COOH的电离程度较小,结合物料守恒得c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故选D.
点评 本题考查离子浓度大小比较,为高频考点,明确混合溶液中溶质及其性质、溶液酸碱性是解本题关键,注意物料守恒的应用及弱电解质电离特点,题目难度不大.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=+817.63 kJ•mol-1 | |
| B. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63 kJ•mol-1 | |
| C. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=-641.63 kJ•mol-1 | |
| D. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-817.63 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 铝能与冷水反应 | |
| C. | 铝热反应常用于冶炼某些熔点较高的金属 | |
| D. | 冶炼铝可用电解AlCl3的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 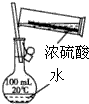 稀释浓硫酸 | |
| B. | 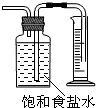 测量Cl2的体积 | |
| C. | 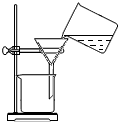 过滤 | |
| D. | 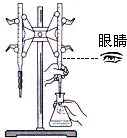 用NaOH标准溶液滴定锥形瓶中的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | 仅②⑤ | C. | 仅②④⑤ | D. | ③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com