
【题目】25℃时,用0.02mol/L的NaOH溶液,分别滴定浓度为0.0lmol/L的三种稀酸溶液,滴定的曲线如右图所示,下列判断正确的是
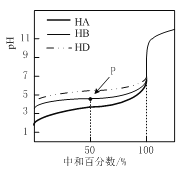
A. 三种酸均为弱酸,且同浓度的稀酸中导电性:HA<HB<HD
B. 滴定至P点时,溶液中:c(HB)>c(B-)
C. 溶液呈中性时,三种溶液中:c(A-)>c(B-)>c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
【答案】C
【解析】
由图象中未加NaOH时三种酸溶液的pH由小到大可知,三种酸的酸性强弱顺序为:HA>HB>HD。
A.酸性越强,酸的电离程度越大,HA的pH最小,酸性最强,电离程度最大,则同浓度的稀酸中离子浓度最大,故等浓度的稀酸溶液的导电性:HA>HB>HD,A错误;
B.滴定至P点时,中和率为50%,HB溶液中的溶质为等物质的量的HB、NaB,由于溶液的pH<7,溶液显酸性,说明HB的电离程度大于B-的水解程度,所以溶液中:c(B-)>c(HB), B错误;
C.pH=7时,溶液中c(H+)=c(OH-),根据电荷守恒,对于HA溶液,c(Na+)=c(A-),对于HB溶液,c(Na+)=c(B-),对于HD溶液,c(Na+)=c(D-),,由于HA、HB、HD的酸性减弱,则使溶液呈中性时,三种溶液中c(Na+)逐渐减小,则c(A-)>c(B-)>c(D-),C正确;
D.当中和百分数达100%时,三种溶液分别恰好存在等量的NaA,NaB,NaD,则起始时c(NaA):c(NaB):c(NaD)=1:1:1,由质子守恒可知c(HA)+c(HB)+c(HD)+c(H+)=c(OH-),则有c(HA)+c(HB)+c(HD)=c(OH-)-c(H+),D错误;
故合理选项是C。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】硫酸亚铁在空气中易被氧化,与硫酸铵反应生成硫酸亚铁铵[化学式为FeSO4·(NH4)2SO4·6H2O]后就不易被氧化。模拟工业制备硫酸亚铁铵晶体的实验装置如下图所示。请回答下列问题:
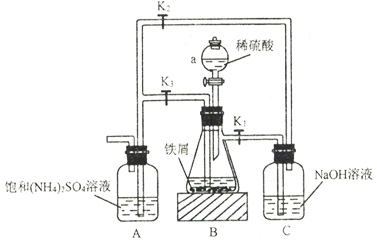
(1)仪器a的名称是______________________。
(2)铁屑中常含有Fe2O3、FeS等杂质,则装置C的作用是___________,装置B中发生反应的离子方程式可能是___________(填序号)。
A .Fe+2H+=Fe2++H2↑
B. Fe2O3+6H+=2Fe3++3H2O
C.2Fe3++S2-=2Fe2++S↓
D.2Fe3++Fe=2Fe2+
(3)按上图连接好装置,经检验气密性良好后加入相应的药品,打开K1、K2,关闭K3,装置B中有气体产生,该气体的作用是___________。反应一段时间后,打开K3,关闭K1和K2。装置B中的溶液会流入装置A,其原因是______________________。
(4)按上图所示装置制备硫酸亚铁铵晶体的安全隐患是______________________。
(5)根据相关物质的溶解度判断,从装置A中分离出硫酸亚铁铵晶体,需采用的操作有___________、___________、洗涤、干燥。
三种盐的溶解度(单位为g/100gH2O)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦炭是重要的工业原材料。
(1)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g) 平衡常数K1;C(s)+H2O(g)
2CO(g) 平衡常数K1;C(s)+H2O(g) ![]() CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g)
CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g) ![]() H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
(2)用焦炭还原NO的反应为:2NO(g)+ C(s)![]() N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_____________ ;
②该反应的平衡常数表达式为__________________;400℃,该反应的平衡常数为_______;
③乙容器的反应温度T____400 ℃(填“>”“<”或“=”)
④丙容器达到平衡时,NO的转化率为___________;平衡时CO2的浓度为________。
⑤在恒容密闭容器中加入焦炭并充入NO气体,下列图像正确且能说明反应达到平衡状态的是___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生反应:2A(g)+B(g)![]() 2C(g),经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是( )
2C(g),经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法中正确的是( )
A. 用物质A表示反应的平均速率为0.3 mol·L-1·s-1
B. 用物质B表示反应的平均速率为0.3 mol·L-1·s-1
C. 2 s时物质A的转化率为70%
D. 2 s时物质B的浓度为0.3 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在恒容密闭容器中,反应2NO2 (g) ![]() N2O4(g) (正反应为放热反应)在一定条件下达到平衡,升高温度容器中气体颜色_____,向容器通人一定量的氦气容器中气体颜色_____。
N2O4(g) (正反应为放热反应)在一定条件下达到平衡,升高温度容器中气体颜色_____,向容器通人一定量的氦气容器中气体颜色_____。
(2)在一定条件下,可逆反应:mA+nB![]() 1/2pC达到平衡,若:
1/2pC达到平衡,若:
①A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是_____。
②A、C是气体,增加B的量,平衡不移动,则B为______________。
③A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是__________。(正向或逆向)
④加热后,可使C的质量增加,则正反应是____________反应(放热或吸热)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间按箭头方向不能通过一步反应实现如图所示转化的是
![]()
物质 选项 | 甲 | 乙 | 丙 |
A | CuO | CO2 | H2O |
B | C | CO | CO2 |
C | CaCO3 | CaO | Ca(OH)2 |
D | H2SO4 | H2O | H2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HX和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
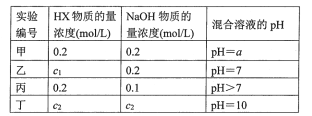
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,若a ___7(填“>""<”或“=”),则HX为强酸;若a_________7(填“>“‘<”或“=”),则HX为弱酸.
(2)在乙组混合溶液中离子浓度c(X-)与c(Na+)的大小关系是____.
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是___ 酸(填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是________.
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=_________mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com