
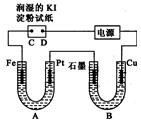
 电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )
电解装置如图所示.图中B装置盛1000mL 3mol•L-1Na2SO4溶液,A装置中盛1000mL 3mol•L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.室温下,若从电解开始到时间为t时,A、B装置中共收集到16.8mL(标准状况)气体.若电解过程中无其他副反应发生,且溶液体积变化忽略不计,下列判断正确的是( )| A. | 电子流动的方向:Fe→Pt→石墨→Cu | |
| B. | B中石墨上可能有红色物质析出 | |
| C. | 若把Fe电极改成Ag电极,可向Pt上镀银 | |
| D. | t时A溶液的pH为3 |
分析 通电一段时间后,发现湿润的淀粉KI试纸的C端变为蓝色,则C端发生2I--2e-=I2,则C端为阳极,D为阴极,Fe电极是阴极,Pt是阳极,石墨是阴极,Cu是阳极,结合离子的放电顺序及发生的电极反应来计算解答.
A、电子只能经过导线;
B、石墨是阴极,该电极上是氢离子得电子的还原反应;
C、若把Fe电极改成Ag电极,此时金属银是阴极,Pt是阳极,电解质是硝酸银溶液;
D、根据电解反应为4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,以及O2↑~4e-~2H2↑,计算氢离子浓度,并计算pH.
解答 解:通电一段时间后,发现湿润的淀粉KI试纸的C端变为蓝色,则C端发生2I--2e-=I2,则C端为阳极,D为阴极,Fe电极是阴极,Pt是阳极,石墨是阴极,Cu是阳极.
A、电子只能经过导线,不会经过电解质,故A错误;
B、石墨是阴极,该电极上是氢离子得电子的还原反应,得到的是无色气体氢气,故B错误;
C、若把Fe电极改成Ag电极,此时金属银是阴极,Pt是阳极,电解质是硝酸银溶液,不能实现向Pt上镀银,故C错误;
D、A装置中盛1000mL 3mol•L-1AgNO3溶液,该电解反应为4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,由装置中O2↑~4e-~2H2↑,A、B装置中共收集到气体0.168L(STP),气体的物质的量为0.00075mol,则n(O2)=0.00025mol,n(H+)=0.00025mol×4=0.001mol,所以c(H+)=$\frac{0.001mol}{1L}$=0.001mol/L,pH=3,故D正确.
故选D.
点评 本题考查原电池和电解池的原理,湿润的淀粉KI试纸的C端变为蓝色为解答本题的突破口,熟悉离子的放电顺序、发生的电极反应即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
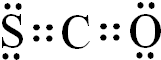 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
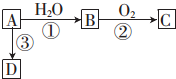 已知A 是一种相对分子质量为28 的气态烃,它可转化为其他常见有机物.转化关系如图所示.
已知A 是一种相对分子质量为28 的气态烃,它可转化为其他常见有机物.转化关系如图所示.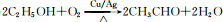 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者所用时间少 | |
| B. | 常温下,氨水与(NH4)2SO4的混合溶液pH=7时,c(NH4+)与c(SO42-) 之比为2:1 | |
| C. | 常温下,0.1 mol•L-1某一元酸HA溶液中$\frac{c{(OH}^{-})}{c{(H}^{+})}$=1×10-12,溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大 | |
| D. | 常温下,V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉溶液中滴入碘水--变蓝色 | B. | 溴化银见光分解--变黑色 | ||
| C. | 苯酚溶液中滴入Fe 3+--变紫色 | D. | 胆矾空气中久置--变白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液 | B. | 稀硫酸 | C. | 酚酞 | D. | Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
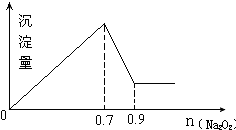
| A. | 1:3 | B. | 2:3 | C. | 6:1 | D. | 3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com