
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、 装置示意图和有关数据如下:

实验步骤:在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯 3.9 g。回答下列问题:
(1)仪器B的名称是________。
(2)在洗涤操作中,第一次水洗的主要目的是_______________;第二次水洗的主要目的是____________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后___(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是______________________________。
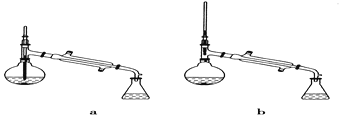
(5)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
(6)本实验的产率是____________。
(7)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏____(填“高” 或“低”),其原因是____________________________________。
【答案】球形冷凝管 洗掉大部分硫酸和乙酸 洗掉碳酸氢钠 d 提高醇的转化率 b 60% 高 会收集少量未反应的异戊醇
【解析】
在装置A中加入反应混合物和2~3片碎瓷片,开始缓慢加热A,利用冷凝管冷凝回流50分钟,反应液冷至室温后,倒入分液漏斗中,先用少量水洗掉大部分硫酸和醋酸,再用碳酸氢钠洗涤除去酸,接着用水洗涤除掉碳酸氢钠溶液,分出的产物加入少量无水硫酸镁固体作干燥剂,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯。
(1)根据题中仪器B的构造判断该仪器的名称;
(2)在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;第二次水洗,主要目的是除去产品中残留的碳酸氢钠;
(3)根据乙酸异戊酯的密度及正确的分液操作方法进行解答;
(4)根据“增加一种反应物的浓度,可以使另一种反应物的转化率提高”判断加入过量乙酸的目的;
(5)先根据温度计在蒸馏操作中的作用排除ad,再根据球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,得出正确结论;
(6)先计算出乙酸和异戊醇的物质的量,然后判断过量情况,根据不足量计算出理论上生成乙酸异戊酯的物质的量,最后根据实际上制取的乙酸异戊酯计算出产率;
(7)若从130℃便开始收集馏分,此时的蒸气中含有异戊醇,会收集少量的未反应的异戊醇,导致获得的乙酸异戊酯质量偏大。
(1)由装置中仪器B的构造可知,仪器B的名称为球形冷凝管;
(2)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;用饱和碳酸氢钠溶液既可以除去未洗净的醋酸,也可以降低酯的溶解度,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠;
(3)由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为d;
(4)酯化反应是可逆反应,增大反应物的浓度可以使平衡正向移动;增加一种反应物的浓度,可以使另一种反应物的转化率提高,因此本实验中加入过量乙酸的目的是提高异戊醇的转化率;
(5)在蒸馏操作中,温度计的水银球要放在蒸馏烧瓶的支管口处,所以ad错误;c中使用的是球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,因此仪器及装置安装正确的是b;
(6)乙酸的物质的量为:![]() ,异戊醇的物质的量为:
,异戊醇的物质的量为:![]() ,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为:
,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为:![]() ,所以实验中乙酸异戊酯的产率为:
,所以实验中乙酸异戊酯的产率为:![]() ;
;
(7)在进行蒸馏操作时,若从130℃便开始收集馏分,根据各物质的沸点,此时的蒸气中含有异戊醇,会收集少量的未反应的异戊醇,因此会导致产率偏高。


科目:高中化学 来源: 题型:
【题目】已知柠檬酸易溶于水和乙醇,有酸性和还原性。用图示裝置(夹持和加热仪器已省略)制备补血剂甘氨酸亚铁![]() (易溶于水,难溶于乙醇)。下列说法错误的是( )
(易溶于水,难溶于乙醇)。下列说法错误的是( )
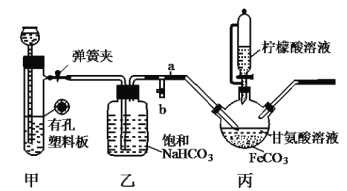
A.装置甲中所盛放的药品可以是石灰石和稀盐酸
B.加入柠檬酸溶液可调节溶液的![]() ,并防止
,并防止![]() 被氧化
被氧化
C.丙中反应方程式为![]()
D.洗涤得到的甘氨酸亚铁所用的最佳试剂是柠檬酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究原电池原理,设计如图装置。下列叙述正确的是( )
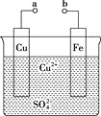
A. a和b不连接时,铁片上会有![]() 产生
产生
B. a和b用导线连接时,铁片上发生的反应为![]()
C. a和b用导线连接时,电子由a流向b
D. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验一种氮肥的成分,某学习小组的同学进行了以下实验:①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊。②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化。由此可知该氮肥的主要成分是( )
A.NH4NO3B.(NH4)2CO3C.NH4ClD.NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是合成二氢荆芥内酯的重要原料,其结构简式如下图,下列检验A中官能团的试剂和顺序正确的是( )
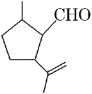
A. 先加酸性高锰酸钾溶液,后加银氨溶液,微热
B. 先加溴水,后加酸性高锰酸钾溶液
C. 先加银氨溶液,微热,再加入溴水
D. 先加入新制氢氧化铜,微热,酸化后再加溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
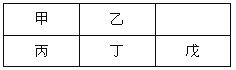
A. 原子半径:丙<丁<戊B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊D. 最外层电子数:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 是阿伏加德罗常数的值,下列说法正确的是
A. 1mol葡萄糖分子含有的羟基数目为6NA
B. 5.8gC4H10中含有共价键总数为1.3NA
C. 5.8g熟石膏(2CaSO4·H2O)含有的结晶水分子数为0.04NA
D. 4.6g乙醇完全氧化成乙醛,转移电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+等)为原料制备氧化锌的流程如下:
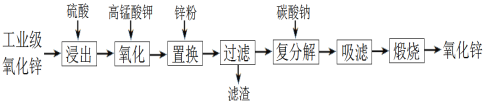
其中“氧化”加入KMnO4是为了除去浸出液中的Fe2+和Mn2+。下列有关说法错误的是
A. 浸出时通过粉碎氧化锌提高了浸出率
B. “氧化”生成的固体是MnO2和Fe(OH)3
C. “置换”加入锌粉是为了除去溶液中的Cu2+、Ni2+等
D. “煅烧”操作用到的仪器:玻璃棒、蒸发皿、泥三角
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com