
| 实验步骤 | 实验现象 | 实验结论 |
| I:取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 | 溶液X中含有钠离子 | |
| II:取少许溶液X于一支试管中,滴加先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液), | 溶液X中含有氯离子 |
分析 (1)KClO3在H2SO4存在下与Na2SO3反应,SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O;
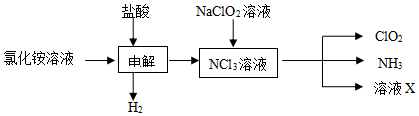
(2)由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,X中含Cl-、OH-;
①由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑;
②I:检验溶液里含有Na+,可利用熖色反应,结合火焰颜色判断;
II:检验溶液里含有Cl-,先用稀硝酸酸化,再滴加硝酸银,根据是否有AgCl白色沉淀生成判断;
③由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体,利用性质差异分离提纯;
(3)亚氯酸盐具有氧化性,Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子.
解答 解:(1)KClO3在H2SO4存在下与Na2SO3反应制得ClO2,可知SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O,氧化剂为KClO3,还原剂为Na2SO3,由离子反应可知该反应氧化剂与还原剂物质的量之比为2:1,故答案为:2:1;
(2)①由生产流程可知氯化铵在盐酸溶液中电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑,
故答案为:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑;
②I:先将铂丝在酒精灯火焰上灼烧至无色,再蘸取少许溶液X在火焰上灼烧,观察火焰呈黄色,证明溶液X中含有Na+;
故答案为:在火焰上灼烧至无色;火焰呈黄色;
II:取少许溶液X于一支试管中,滴加硝酸酸化,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液),有白色沉淀生成,证明溶液X中含有Cl-,
故答案为:先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液);产生白色沉淀;
③a.ClO2易溶于水,不能利用水吸收氨,故a错误;
b.碱石灰不能吸收氨气,故b错误;
c.浓硫酸可以吸收氨气,且不影响ClO2,故c正确;
d.ClO2易溶于水,不能利用饱和食盐水吸收氨气,故d错误;
故答案为:c;
(3)若要除去超标的亚氯酸盐,ac均不能还原亚氯酸盐,b中KI具有还原性但氧化产物不适合饮用水使用,只有d中Fe2+将ClO2-还原成Cl-,Fe2+ 被氧化为铁离子,且铁离子水解生成胶体可净化饮用水,则最适宜的是d,
故答案为:d.
点评 本题考查物质含量的测定,为高频考点,为2015年高考真题选编,把握物质的性质、制备流程、发生的反应为解答的关键,侧重分析与实验、计算能力的综合考查,综合性较强,题目难度中等.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
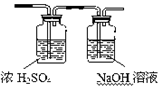 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③①⑤ | B. | ②③⑤① | C. | ④⑥③① | D. | ④⑤⑥③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验目的 | 验证HCl水溶液的酸性 | 检验葡萄糖的醛基 | 配制一定质量分数的AlCl3水溶液 | 测定中和反应的反应热 |
| 实验方案设计 |  | 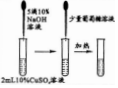 | 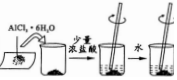 | 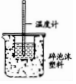 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定中和反应反应热实验中,为了充分反应,应将NaOH溶液缓缓倒入盐酸中 | |
| B. | 配制FeCl3溶液时,将FeCl3,晶体溶解在较浓的盐酸中,再加蒸馏水稀释到所需浓度 | |
| C. | 用盐酸滴定NaOH溶液时,左手控制酸式滴定管活塞,右手振荡锥形瓶,眼睛注视滴定管内液面 | |
| D. | 检验Fe(NOs)2晶体是否变质时,将Fe(NO3)2样品溶于稀H2SO4后,再滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y<Z<W | |
| B. | X元素的最高正价和最低负价的绝对值相等 | |
| C. | Y的单质化学性质很稳定,不与任何金属发生反应 | |
| D. | 工业上通常用W和R形成的化合物来冶炼金属W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com