
【题目】设NA 为阿伏加德罗常数的值。下列说法正确的是
A. 22.0gT2O 中含有的中子数为10NA
B. 7.2g过氧化钙(CaO2)固体中阴、阳离子总数为0.3NA
C. 6.2LNO2溶于足量水中,充分反应后转移的电子数为0.2NA
D. 标准状况下,2.24LNO 和2.24LO2混合充分反应后,原子总数是4NA
【答案】D
【解析】A、22.0gT2O的物质的量为: ![]() =1mol,含有中子的物质的量为:1mol×12=12mol,含有的中子数为12NA,故A错误;B、7.2g过氧化钙的物质的量为0.1mol,而过氧化钙由钙离子和过氧根构成,故0.1mol过氧化钙中含0.2mol离子即0.1 NA个,故B错误;C、未说明是否为标准状况,无法计算6.2LNO2气体的物质的量,无法计算转移的电子数,故C错误;D、标准状况下,2.24LNO和2.24LO2的物质的量均为0.1mol,由于NO和氧气均为双原子分子,故0.1molNO和0.1molO2中含0.4mol原子,而反应过程中满足原子个数守恒,故反应后体系中原子总数为0.4NA,故D正确;故选D。
=1mol,含有中子的物质的量为:1mol×12=12mol,含有的中子数为12NA,故A错误;B、7.2g过氧化钙的物质的量为0.1mol,而过氧化钙由钙离子和过氧根构成,故0.1mol过氧化钙中含0.2mol离子即0.1 NA个,故B错误;C、未说明是否为标准状况,无法计算6.2LNO2气体的物质的量,无法计算转移的电子数,故C错误;D、标准状况下,2.24LNO和2.24LO2的物质的量均为0.1mol,由于NO和氧气均为双原子分子,故0.1molNO和0.1molO2中含0.4mol原子,而反应过程中满足原子个数守恒,故反应后体系中原子总数为0.4NA,故D正确;故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法.
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去.已知室温下Ksp(FeS)=6.3×10﹣18mol2L﹣2 , Ksp(CuS)=1.3×10﹣36mol2L﹣2 . ①请用离子方程式说明上述除杂的原理 .
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是(填序号)
A.Ba(NO3)2B.BaCl2
C.Ba(OH)2D.溶有NH3的BaCl2溶液
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 .
(2)电解法处理酸性含铬废水(主要含有Cr2O72﹣)时,在废水中加入适量NaCl,以铁板作阴、阳极,处理过程中存在如下反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是(填序号)
A.阳极反应为Fe﹣2e﹣═Fe2+
B.电解过程中溶液pH减小
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2mol Cr2O72﹣被还原
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池.图是该燃料电池示意图,产生的X气体可直接排放到大气中,a电极作极(填“正”“负”“阴”或“阳”),其电极反应式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
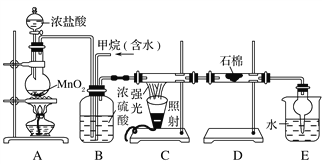
根据设计要求回答:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应________。
(3)D装置的石棉中均匀混有KI粉末,其作用是________________________________________。
(4)E装置的作用是____________(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式____________________________________。
(6)E装置除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为______(填编号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 利用化石燃料燃烧放出的热量使水分解产生氢气,是氢能开发的研究方向
B. 光合作用是将光能转化为化学能的有效途径
C. 石油、煤、天然气属于二次能源
D. 绿色化学最显著的特征是在生产化工产品过程中必须利用绿色植物为原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1 mol CO2的质量为44g/mol
B. H2SO4的摩尔质量为98
C. 标准状况下,气体摩尔体积约为22.4 L
D. O2的相对分子质量为32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、R、Y、Z、M为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示,R的原子序数大于Z。下列说法错误的是

A. R的氧化物只含有离子键
B. 最高价含氧酸的酸性:Y<M
C. 最简单氢化物的稳定性:Y<Z
D. Z的简单氢化物可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混和气为阴极助燃气,制得在650℃下工作的燃料电池,已知其电池反应相当于CO的燃烧,且负极反应式为2CO+2CO ![]() ﹣4e﹣=4CO2
﹣4e﹣=4CO2
(1)该电池的正极反应式为;
(2)若用该燃料电池与如图装置连接模拟工业电解食盐水,则铁棒应连接电源的(填写“正极”或“负极”),电解总反应的离子方程式为 . 当电池内通过0.2mol 电子时,电解装置中两极共生成气体L(标准状况下),此时将电解液充分混合,溶液的pH(不考虑溶液体积的变化).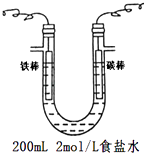
(3)利用该燃料电池做电源,以NiSO4溶液为电解质溶液进行粗镍(含Fe、Zn、Cu、Pt、Au等杂质)的电解精炼,下列说法正确的是(填代号).(已知氧化性:Fe2+<Ni2+<Cu2+)a.电解过程中,化学能转化为电能 b.粗镍作阳极,发生还原反应
c.利用阳极泥可回收Cu、Pt、Au等金属 d.粗镍精炼时通过的电量与阴极析出镍的质量成正比.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2与水的反应可表示为:3NO2+H2O=2HNO3+NO,关于此反应中的下列说法正确的是( )
A.氮元素的化合价没有发生变化
B.NO2只是氧化剂
C.NO2只是还原剂
D.NO2既是氧化剂,又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是:( )
A. 向NaOH溶液中通入足量SO2: SO2 + 2OH- = SO32-+ H2O
B. 向KI与稀硫酸的混合溶液中通入氧气: 4H+ + 4I-+ O2= 2I2 +2H2O
C. 等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:2HCO![]() +Ba2++2OH-=BaCO3↓+ 2H2O
+Ba2++2OH-=BaCO3↓+ 2H2O
D. 硫酸亚铁溶液与稀硫酸、双氧水混合: Fe2+ + 2H2O2 + 4H+ = Fe3+ + 4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com