
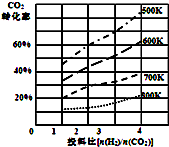
 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)分析 (1)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
(2)①根据温度对平衡的影响分析△H的符号;
②平衡常数K只与温度有关;
③由图可知,在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=2时,二氧化碳转化率为30%,令CO2、H2的起始物质的量分别为1mol、2mol,转化的二氧化碳为0.3mol,根据方程式可知转化的氢气为0.9mol,进而计算H2 的转化率;
(3)当可逆反应达到平衡状态时,正逆反应速率相等,反应体现中各物质的物质的量、物质的量浓度及百分含量都不变,以及由此引起的一些物理量不变,据此分析解答;
解答 解:(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以平衡常数K=$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$,故答案为:$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$;
(2)①因为温度越高,CO2转化率越小,则平衡逆移,所以该反应正方向为放热反应,即△H<0,故答案为:<;
②K只受温度影响,若温度不变,减小投料比,则K不变,
故答案为:不变;
③由图可知,在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=2时,二氧化碳转化率为30%,令CO2、H2的起始物质的量分别为1mol、2mol,转化的二氧化碳为0.3mol,根据方程式可知转化的氢气为0.9mol,进而计算H2 的转化率=$\frac{0.9mol}{2mol}$×100%=45%,
故答案为:45%;
(3)A.二氧化碳的浓度不变,则达到了平衡,故A选;
B.反应前后气体的系数和不相等,当容器内压强不再改变,则达到了平衡,故B选;
C.该反应是一个反应前后气体体积变化的可逆反应,容器的体积不变,但反应前后气体质量变化,气体的密度不发生变化,则达到了平衡,故C选;
D.任何时候CH3OCH3与H2O的物质的量之比不变,不能说明反应达到平衡,故D不选;
故答案为:ABC.
点评 本题考查了化学平衡计算、影响平衡的因素分析、平衡常数和转化率计算等知识点,主要是图象的理解应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋 | 红色很快褪为无色 | 随溶液pH减小,NaClO的氧化能力增强 |
| B | 向某氯化亚铁溶液中加入Na2O2粉末 | 出现红褐色沉淀 | 说明原氯化亚铁已氧化变质 |
| C | 苯酚和水的浊液中,加Na2CO3溶液 | 溶液变澄清 | 苯酚的酸性比碳酸强 |
| D | 向溶液X中加入NaHCO3粉末 | 产生无色气体 | 溶液X的溶质一定属于酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以极性键结合起来的分子一定是极性分子 | |
| B. | 非极性分子中,一定含有非极性共价键 | |
| C. | 乙醇分子和水分子间只存在范德华力 | |
| D. | 卤素单质按F2→I2,熔沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒容密闭容器中进行的反应3A(g)?B(g)+c(g),在其他条件不变的情况下,再充入一定量的A气体,A的转化率将增大 | |
| B. | 对于可逆反应N2(g)+3H2(g)?2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加 | |
| C. | 将FeCl3溶液和NaAlO2溶液相混,所得固体产物Fe(OH)3 | |
| D. | 反应NH3(g)+HCl(g)?NH4Cl(s)△H<O在任何条件下均能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解度(s) | B. | 物质的量浓度(c) | C. | 质量分数(w) | D. | 摩尔质量(M) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com