
| m |
| M |
| 1.25g |
| 100g/mol |
| ||


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| A、①②③④ | B、③②①④ |
| C、④③①② | D、③②④① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Mn2+ |
| Mn2+ |
| Mn2+ |
| C2O42- |
| 实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪 色时间 (s) | |||
| 0.10mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | 18 | |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5mL 0.10mol/L K2SO4溶液 | 18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
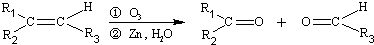 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
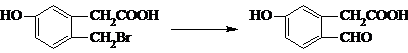
 :
:
 属芳香醚,其同系物的通式为:
属芳香醚,其同系物的通式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
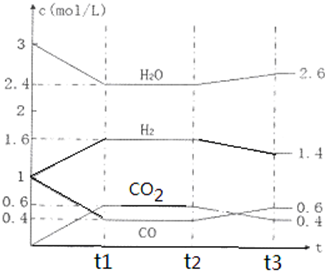

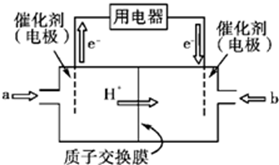
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、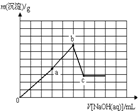 |
B、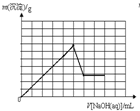 |
C、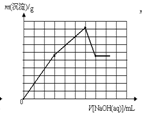 |
D、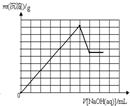 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com