
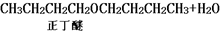
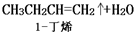
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |
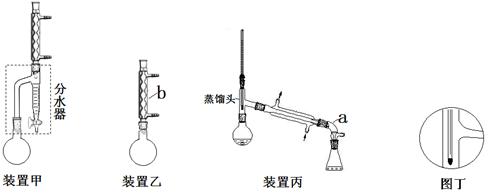


分析 (1)减小生成物浓度平衡向正反应方向移动;
(2)仪器a是接受气或牛角管,仪器b是球形冷凝管;
(3)乙酸能和碳酸钠反应生成可溶性的乙酸钠;硫酸镁具有吸水性;
(4)分液漏斗的使用方法为:
A.分液漏斗使用前必须要检漏,要分液漏斗的旋塞芯处和上口的活塞都不漏水才可使用;
B.洗涤时振摇放气,应打开分液漏斗的旋塞,此时分液漏斗下管口应略高于口部;
C.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,使内外压强相等,便于液体流下;
D.洗涤完成后,先放出下层液体,然后从上口倒出有机层置于干燥的锥形瓶中;
(5)要蒸馏时,烧瓶最后留下的物质为沸点最高的物质,据此判断;若按图丁放置温度计,水银球的位置偏低,则收集到的产品馏分中还含有沸点较低的物质,据此判断;
(6)乙酸和正丁醇制备乙酸正丁酯是可逆反应,根据实验装置图可知,该实验通过分水器及时分离出产物水,有利于酯化反应的进行,提高酯的产率.
解答 解:(1)减少生成物浓度,平衡正向移动,所以将水蒸气放出后水蒸气在装置中的浓度降低,平衡正向移动,增大产率,
故答案为:有利于平衡向生成乙酸正丁酯的反应方向移动;
(2)a的名称是接受器或牛角管,b的名称是球形冷凝管,
故答案为:接受器(或牛角管); (球形)冷凝管;
(3)得到的反应液中含有未反应的乙酸,乙酸能和碳酸钠反应生成可溶性的乙酸钠,所以可以用饱和的碳酸钠除去乙酸;硫酸镁具有吸水性,能干燥产物,故答案为:为了除去有机层中残留的酸;干燥;
(4)分液漏斗的使用方法为:
A.分液漏斗使用前必须要检漏,要分液漏斗的旋塞芯处和上口的活塞都不漏水才可使用,故A正确;
B.洗涤时振摇放气,应打开分液漏斗的旋塞,此时分液漏斗下管口应略高于口部,故B正确;
C.放出下层液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔,使内外压强相等,便于液体流下,故C错误;
D.洗涤完成后,先放出下层液体,然后从上口倒出有机层置于干燥的锥形瓶中,故D错误,
故答案为:AB;
(5)要蒸馏时,烧瓶最后留下的物质为沸点最高的物质,所以最后圆底烧瓶中残留的液体主要是正丁醚;若按图丁放置温度计,水银球的位置偏低,则收集到的产品馏分中还含有沸点较低的物质,所以收集到的产品馏分中还含有正丁醇,
故答案为:正丁醚;正丁醇;
(6)乙酸和正丁醇制备乙酸正丁酯是可逆反应,根据实验装置图可知,该实验通过分水器及时分离出产物水,有利于酯化反应的进行,提高酯的产率,
故答案为:通过分水器及时分离出产物水,有利于酯化反应的进行,提高酯的产率.
点评 本题考查制备实验方案设计及实验评价,涉及化学仪器名称及使用、反应原理、实验基本操作、实验评价等知识点,明确实验原理、仪器名称及其用途、实验基本操作规范性是解本题关键,侧重考查学生实验操作、分析评价能力,难点是(5)题中物质成分判断,注意结合表中数据分析解答.


科目:高中化学 来源: 题型:解答题
 为了分别研究SO2和Cl2的性质,设计了如图1所示的实验装置.
为了分别研究SO2和Cl2的性质,设计了如图1所示的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热晶体时先用小火,后渐改为用大火加热至晶体变白 | |
| B. | 灼烧时如有晶体溅出容器,应再加一些晶体继续加热 | |
| C. | 加热后的冷却放在干燥器中进行 | |
| D. | 加热、冷却、称量,重复多次即是恒重操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/(g/cm3) | 溶解性 |
| 甲醇 | 64.7 | - | 0.795 | 易溶于水 |
| 乙醚 | 34.5 | - | 0.7138 | 难溶于水 |
| 3,5-二甲氧基苯酚 | 172 | 36 | - | 易溶于甲醇、乙醚、微溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com