
���� ��1����������Ni����������������2�������������Ni��ԭ������Ϊ28���ݴ˷����������ڱ��е�λ�ã�
��2���ɷ���ʽ��֪���ŵ�ʱ��Fe����������Fe��OH��2��FeΪ������
��3�����س��ʱ�ǵ���ԭ������������������Ӧ���ݴ˽������ܷ�Ӧд���缫��Ӧʽ��
��4�����NaCl��Һ���ҵ��صĵ缫��Ϊ���Ե缫�����������������缫����ʽΪ2H++2e-=H2�������������������缫����ʽΪ2Cl--2e-=Cl2�������ݵ����غ���㣻
��5������μ���NaOH��Һ���տ�ʼ����ʱ��Ҫ��c��OH-��ԽСԽ�ȳ����������ܶȻ��������㣻
�ڸ����ܶȻ��������㣮
��� �⣺��1����������Ni����������������2�������������Ni��ԭ������Ϊ28��λ�����ڱ��������ڵڢ��壬
�ʴ�Ϊ���ģ�����
��2���ɷ���ʽ��֪���ŵ�ʱ��Fe����������Fe��OH��2��FeΪ�������缫�Ϸ���������Ӧ��������Fe��
�ʴ�Ϊ��B��
��3�����س��ʱ�ǵ���ԭ������������������Ӧ��������֪�ܷ�Ӧ�ɵ������缫��ӦʽΪ��Ni��OH��2+2OH--2e -=NiO2+2H2O��
�ʴ�Ϊ��Ni��OH��2+2OH--2e -=NiO2+2H2O��
��4�����NaCl��Һ���ҵ��صĵ缫��Ϊ���Ե缫�����������������缫����ʽΪ2H++2e-=H2�������������������缫����ʽΪ2Cl--2e-=Cl2������·��ת����0.1mol e-����֪����0.05molCl2�����Ϊ0.05mol��22.4L/mol=1.12L������c��OH-��=$\frac{0.1mol}{1L}$=0.1mol/L����c��H+��=$\frac{1��1{0}^{-14}}{0.1}$=1��10-13����Һ��pH=13��
�ʴ�Ϊ��1.12L��13��
��5������μ���NaOH��Һ���տ�ʼ����ʱ��Ҫ��c��OH-��ԽСԽ�ȳ����������ܶȻ�������Fe3+��ʼ����ʱ��Ҫ��c��OH-��=$\root{3}{\frac{8.0��{10}^{-38}}{0.1}}$=2��10-13mol/L��Ni2+��ʼ����ʱ��Ҫ��c��OH-��=$\sqrt{\frac{1.0��{10}^{-15}}{0.1}}$=10-8mol/L��Fe3+��ʼ����ʱ��Ҫ��c��OH-����Ni2+��ʼ����ʱ��Ҫ��c��OH-��С����Fe3+�ȳ������ʴ�Ϊ��Fe3+��
�ڸ����ܶȻ�������Fe3+������ȫc��OH-��Ӧ����$\root{3}{\frac{8.0��{10}^{-38}}{1��1{0}^{-5}}}$=2��10-11mol/L��c��H+��=$\frac{1��1{0}^{-14}}{2��1{0}^{-11}}$=5��10-4mol/L����Һ��pH��3.3��Ni2+��ʼ����ʱ��Ҫ��c��OH-��=$\sqrt{\frac{1.0��{10}^{-15}}{0.1}}$=10-7mol/L��c��H+��=$\frac{1��1{0}^{-14}}{1{0}^{-7}}$=10-7mol/L��Ni2+����������Һ��pH������С��7����Ҫ��ʹFe3+������ȫ��Ni2+����������Һ��pH����Ƶķ�Χ��3.3-7��
�ʴ�Ϊ��3.3-7��
���� ���⿼��ԭ��غ͵���֪ʶ�������ܶȻ�����������ؼ��㣬Ϊ��Ƶ���㣬������ѧ���ķ��������������Ŀ��飬��Ŀ�Ѷ��еȣ�ע����յ缫����ʽ����д��Ϊ������Ĺؼ���Ҳ���״��㣬����ʱע����ᣮ



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
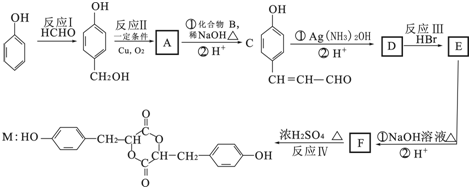
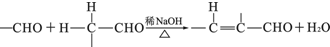
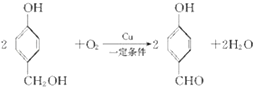 ��
�� ��
�� ����2�֣���д���֣���
����2�֣���д���֣���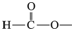
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
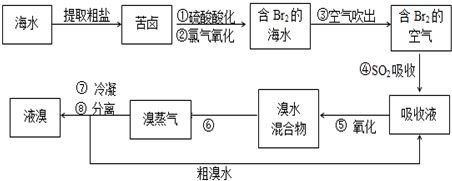
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
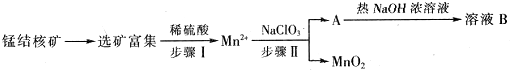
| ������ | Zn��OH��2 | Fe��OH��2 | Fe��OH��3 |
| Ksp����ֵ | 10-17 | 10-17 | 10-39 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������ȣ�ClO2���ǹ�����ϵĸ�Ч�����ס����١���ȫ����ɱ��������������Ϊ����4��������������ҵ�Ͽɲ��������ƣ�NaClO3�����������ƣ�NaClO2��Ϊԭ���Ʊ�ClO2��
�������ȣ�ClO2���ǹ�����ϵĸ�Ч�����ס����١���ȫ����ɱ��������������Ϊ����4��������������ҵ�Ͽɲ��������ƣ�NaClO3�����������ƣ�NaClO2��Ϊԭ���Ʊ�ClO2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ijѧ����Na2SO3��AgNO3�ڲ�ͬpH�µķ�Ӧ����̽����
ijѧ����Na2SO3��AgNO3�ڲ�ͬpH�µķ�Ӧ����̽����| ʵ�� | pH | ���� |
| A | 10 | ������ɫ�������Ժ��ܽ⣬��Һ���� |
| B | 6 | ������ɫ������һ��ʱ�����δ�ܽ� |
| C | 2 | ����������ɫ������һ��ʱ���������״�غ�ɫ����X |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��

| A�� | ��������������̼ԭ��һ������ͬһƽ���� | |
| B�� | ��ϩ�Ʒӿɷ����ӳɡ�ȡ�����������Ӿۡ�������Ӧ | |
| C�� | �����ͼ�ϩ�ƷӶ����ڷ����廯���� | |
| D�� | ��1mol�������ͼ�ϩ�Ʒӷֱ����������3mol ��6mol Br2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=5��NH4Cl��Һ�������Һ�У���ˮ������� c��H+����Ϊ10-9mol•L-1 | |
| B�� | �����£���pH=3�Ĵ����pH=11��NaOH��Һ�������Ϻ�pH��7 | |
| C�� | ��c��H+����c��OH-��=1��l012����Һ�У�Na+��I-��NO3-��SO42-�ܴ������� | |
| D�� | 0.1 mol•L-1 Na2CO3��Һ��0.1 mol•L-1 NaHSO4��Һ�������ϣ���Һ�У�c��Na+��+c��H+��=c��CO32-��+c��SO42-��+c��HCO3-��+c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ���� | ||
| C�� | 2-�����飨CH3��3CH | D�� | 2��2-�������飨CH3��4C |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com