
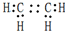 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.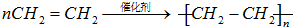 ,反应类型是加聚反应.
,反应类型是加聚反应.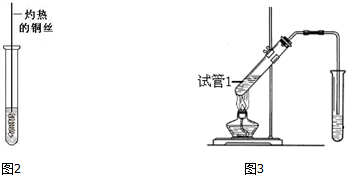
 ,
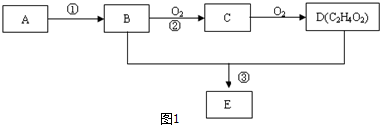
,分析 气态烃A在标准状况下的密度是1.25g/L,其摩尔质量=1.25g/L×22.4L/mol=28g/mol,则A为CH2=CH2;B氧化生成C、C氧化生成D,B和D都是生活中常见的有机物,结合D的分子式可知,B为CH3CH2OH,C为CH3CHO,D为CH3COOH,故反应①是乙烯与水发生加成反应生成CH3CH2OH,CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应生成E为CH3COOCH2CH3.
解答 解:气态烃A在标准状况下的密度是1.25g/L,其摩尔质量=1.25g/L×22.4L/mol=28g/mol,则A为CH2=CH2;B氧化生成C、C氧化生成D,B和D都是生活中常见的有机物,结合D的分子式可知,B为CH3CH2OH,C为CH3CHO,D为CH3COOH,故反应①是乙烯与水发生加成反应生成CH3CH2OH,CH3CH2OH和CH3COOH在浓硫酸作用下发生酯化反应生成E为CH3COOCH2CH3.
(1)A为CH2=CH2,A的电子式为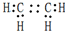 ,D为CH3COOH,D中官能团的名称为羧基,
,D为CH3COOH,D中官能团的名称为羧基,
故答案为: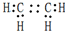 ;羧基;
;羧基;
(2)乙烯发生加聚反应生成聚乙烯,反应方程式为: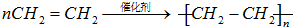 ,
,
故答案为: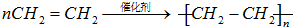 ;加聚反应;
;加聚反应;
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图2所示),重复操作2-3次,观察到的现象是:铜丝由黑色变红色,产生刺激性气味,
过程②反应方程式:CH3CH2OH+CuO$\stackrel{△}{→}$Cu+CH3CHO+H2O,
故答案为:铜丝由黑色变红色,产生刺激性气味;CH3CH2OH+CuO$\stackrel{△}{→}$Cu+CH3CHO+H2O;
(4)①试管1中实现反应③的化学方程式为: ,
,
故答案为: ;
;
②加热的目的是加快反应速率,小火加热而不是大火的目的是:防止由于温度过高使反应物来不及充分反应而被蒸出,同时防止副产物乙醚等生成,
故答案为:防止由于温度过高使反应物来不及充分反应而被蒸出,同时防止副产物乙醚等生成.
点评 本题考查有机物推断、乙酸乙酯制备等,涉及烯与醇、醛、羧酸之间的转化关系,难度不大,注意基础知识的理解掌握.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.7g OH- 所含电子数为0.9NA | |
| B. | 标准状况下,11.2 L HCl 所含质子数为18NA | |
| C. | 常温下,11.2 L Cl2 气所含原子数为NA | |
| D. | 0.5 mol D2O 中所含质子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与乙烯共1 mol,完全燃烧后生成2mol H2O | |
| B. | 光照下,异丁烷与Cl2发生取代反应生成的一氯代物有2种 | |
| C. | 乙烯可以用作生产食品包装材料的原料 | |
| D. | 乙烷室温下能与浓盐酸发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
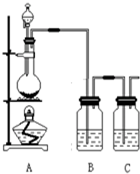 为了验证氯元素的非金属性比碘元素的非金属性强,某化学实验小组利用题中所给试剂设计了如下实验,请回答下列问题:
为了验证氯元素的非金属性比碘元素的非金属性强,某化学实验小组利用题中所给试剂设计了如下实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往氯化铝溶液中滴加过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| B. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| C. | 往澄清石灰水中通入过量CO2:CO2+OH-=HCO3- | |
| D. | 铁粉和浓盐酸反应:Fe+2H+=Fe2++H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com