
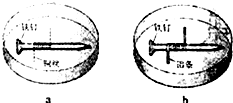
 (2008?重庆)如题图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )
(2008?重庆)如题图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )

科目:高中化学 来源: 题型:
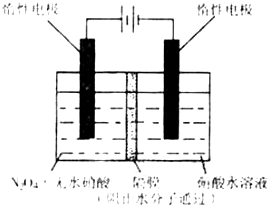 (2008?重庆)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
(2008?重庆)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.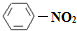
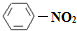
| t/s | 0 | 500 | 1000 |
| e(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
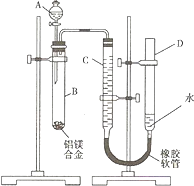 (2008?重庆)某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
(2008?重庆)某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.| 33600(a-c) |
| b |
| 33600(a-c) |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ?mol-1
B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ?mol-1
C.![]() N2(g)+
N2(g)+![]() H2(g)=NH3(1); △H=(h+c-a)kJ?mol-1
H2(g)=NH3(1); △H=(h+c-a)kJ?mol-1
D. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g); △H=(a+b)kJ?mol-1
H2(g)=NH3(g); △H=(a+b)kJ?mol-1

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com